(6分)向50.0g8.O%的氢氧化钠溶液中加入一定量的稀硫酸恰好完全反应,此时溶液pH=7.(1)求反应前氢氧化钠溶液中溶质的质量
题目
(6分)向50.0g8.O%的氢氧化钠溶液中加入一定量的稀硫酸恰好完全反应,此时溶液pH=7.
(1)求反应前氢氧化钠溶液中溶质的质量
相似考题
更多“(6分)向50.0g8.O%的氢氧化钠溶液中加入一定量的稀硫酸恰好完全反应,此时溶液pH=7. (1)求反应 ”相关问题
-
第1题:
体积水(密度为1 g/cm)吸收了560体积(标准状况下)氨气,所得氨水的密度为0.90 g/cm,求此溶液中溶质的质量分数.用此氨水10 mL与含7.74 g H,PO4的溶液混合,恰好完全反应,求此反应生成盐的分子式.答案:解析:
【解题指要】
(1)解此题首先应把体积单位具体化.设其为“L”,变为“1 L水溶解560 L(标准状况下)NH3”,这样便于计算.
(2)因NH3与H3PO4反应,可能有三种产物:NH4H2PO4、(NH4)2HPO4和(NH4)3PO4,所以应知道n(NH3)与n(H3PO4)的比值,才能知道生成盐的分子式. -
第2题:
现称取变质的氢氧化钠样品10g,配制成溶液,再向其中加入CaCl2溶液(反应的化学方程式为:Na2CO3+CaCl2 = CaCO3↓+2NaCl)。反应时CaCl2溶液与沉淀的质量关系如图所示。请解决以下问题: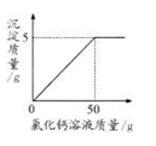
(1)计算样品中NaOH的质量;
(2)计算所加CaCl2溶液的溶质质量分数;
(3)恰好完全反应时烧杯中溶液的pH______7(选填“>”、“<”或“=”)答案:解析:(1)解:设样品中碳酸钠的质量为x,加入的氯化钙溶液中的溶质质量为y
Na2C03+CaCl2=CaC03↓ +2NaCl
106 111 100
x Y 5 g
106/100=x/5g
x=5.3 g
该样品中NaOH的质量为l0 g-5.3 g=4.7 g
(2)111/y=100/5g
y= 5.55 g
所加CaCl2溶液的溶质质量分数=5.55g/50g×l00%=11.1%
答:样品中NaOH的质量为4.7 g,所加CaCl2溶液的溶质质量分数为ll.1%
(3) > -
第3题:
25℃时,某200ml一元弱酸HA溶液浓度为0.12 mol·L-1,已知pKa=3.75。 (1)求该溶液pH。 (2)若在该溶液中加入0.10 mol·L-1NaOH溶液100ml, 求这时溶液的pH。 (3)若在该溶液中加入0.12 mol·L-1NaOH溶液200ml, 求这时溶液的pH。
C 因酸碱都是一元的,所以恰好完全反应。由于酸HA的强弱不明确,要具体分析。若HA是强酸,则c=0.1mol/L,pH=1,此时A、B正确;若HA是弱酸,则c>0.1mol/L,MA水解。但,无论HA是强酸还是弱酸,溶液中的电荷恒等式c(H + )+c(M + )=c(OH - )+c(A - )总是成立的。 -
第4题:
能用离子方程式H++OH-H2O表示的反应是( )。A.稀盐酸和氢氧化钠反应
B.稀氨水与稀盐酸
C.稀硫酸和氢氧化钾溶液反应
D.稀硫酸和氢氧化钡溶液反应答案:A,C解析: -
第5题:
1、25℃时,某200ml一元弱酸HA溶液浓度为0.12 mol·L-1,已知pKa=3.75。 (1)求该溶液pH。 (2)若在该溶液中加入0.10 mol·L-1NaOH溶液100ml, 求这时溶液的pH。 (3)若在该溶液中加入0.12 mol·L-1NaOH溶液200ml, 求这时溶液的pH。
平衡常数1.0×10 -6 ;解离度α=1.0%
