锌与盐酸(HCl)反应生成氢气和氯化锌。实验室里用6.5g锌与足量盐酸反应,可制得氢气和氯化锌的质量各是多少?
题目
锌与盐酸(HCl)反应生成氢气和氯化锌。实验室里用6.5g锌与足量盐酸反应,可
制得氢气和氯化锌的质量各是多少?
相似考题
参考答案和解析
解:设制得H2的质量为x,ZnCl2 的质量为y。
Zn+2HCl=ZnCl2+H2↑
65 136 2
6.5 g y x
x=6.5g×2/65=0.2g
y=136×6.5g/65=13.6g
答:可制得H2的质量约为0.2 g,ZnCl2的质量约为13.6 g。
更多“锌与盐酸(HCl)反应生成氢气和氯化锌。实验室里用6.5g锌与足量盐酸反应,可制得氢气和氯化 ”相关问题
-
第1题:
如图所示,天平左右两端的烧杯中有等量稀盐酸,并处于平衡状态。现在天平左右两端的烧杯中,分别加入相同质量的锌块与铜块,结果发现天平右侧缓慢下降,主要的原因是( )。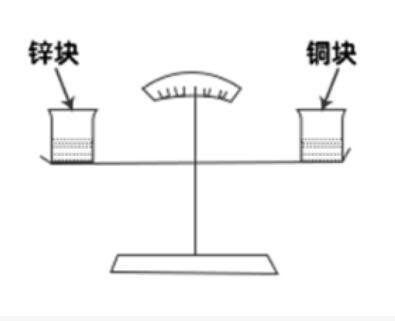 A.相同质量的铜块与锌块大小不同
A.相同质量的铜块与锌块大小不同
B.铜块与稀盐酸反应产生了氯化铜
C.锌块与稀盐酸反应产生了氢气
D.化学反应产生了大量水蒸气答案:C解析:第一步,确定题型。
本题考查化学反应。
第二步,根据天平的状态进行分析。
①初始:天平两端有等量稀盐酸,并处于平衡状态。
②过程:相同质量的锌块与铜块分别加入天平左右两端。
③结果:天平右侧(铜块)缓慢下降。
第三步,分析选项。
A项:天平是称质量的,整体的上升和下降只与物体的质量有关系,与体积没有关系,排除;
B项:铜块与稀盐酸不反应,排除;
C项:锌块和稀盐酸反应产生了氢气,质量变轻,符合;
D项:铜块不与稀盐酸发生反应,锌块和稀盐酸反应产生氢气,不是水蒸气,排除。
因此,选择C选项。 -
第2题:
碘酸与金属锌反应能生成氢气。()
B -
第3题:
金 属 锌 可 以 与 过 量 的 氨 水 反 应 生 成 氢 气 。
正确 -
第4题:
一、考题回顾

二、考题解析
【教学过程】
环节一:生活导入
【提出问题】厨房用来盛装醋的容器,一般不采用铝制品,原因是什么?
【学生回答】铝制品会与醋酸发生化学反应。
【教师引导】金属与其他酸能否发生反应?
环节二:新课教学
【教师演示实验】镁条与盐酸的反应,检验生成的气体。
【提出问题】镁条与盐酸反应生成的气体是何种气体?
【学生回答】试管口接近酒精灯火焰,能听到清脆的爆鸣声,判断生成的气体是氢气。
【提出问题】铁、锌、铜能否与盐酸发生反应生成氢气,这四种金属与硫酸反应的实验现象是怎样的,反应的化学方程式应该如何书写。
(学生自主实验环节,分别进行镁、锌、铁、铜与盐酸、硫酸的反应,记录发生反应的实验现象,反应的剧烈程度,书写反应的方程式。)
【学生回答,教师总结】
镁、锌、铁都能与盐酸、硫酸反应生成氢气,铜不能与盐酸、硫酸发生反应,书写化学方程式如下:
【提出问题】以小组为单位思考如下的问题:
①哪些金属能与盐酸、稀硫酸发生反应?反应的剧烈程度如何?反应后生成了什么气体?哪些金属不能与盐酸、稀硫酸发生反应?根据反应时是否有氢气产生,将金属分为两类。
②对于能发生的反应,从反应物和生成物的物质类别如单质、化合物的角度分析,这些反应有什么特点?将这一类反应与化合反应、分解反应进行比较。
【学生回答,教师总结】
①镁、锌、铁能与酸发生反应,反应剧烈程度由大到小依次为镁、锌、铁、铜,且镁、铁、锌与酸反应均放出氢气,铜不与酸反应;
②这些反应都属于一种单质和一种化合物反应生成另外一种单质和另外一种化合物的反应。反应类型不同于化合反应、分解反应。
【教师引导】这几个反应都是由一种单质与一种化合物的反应,生成另一种单质和另一种化合物。这种反应叫做置换反应。
【提出问题】通过金属与酸反应实验的探究,你能够得到什么结论?
【学生回答】镁、锌、铁的金属活泼性比铜强,他们能置换出酸中的氢,而反应速度镁大于锌,锌大于铁,所活动性镁大于锌大于铁。
环节三:巩固提高
下列反应属于化合反应、分解反应、置换反应中那种反应类型?。 答案:解析:
答案:解析: -
第5题:
下列反应能生成芳香胺的是
A.苯基甲基酮与锌汞齐/浓盐酸反应
B.苯乙酰胺与溴/氢氧化钠溶液反应
C.苯乙腈与氢气/Ni反应
D.对硝基甲苯与锡/盐酸反应
本题答案:A
