有两种金属的混合粉末15 g,加入足量的盐酸,充分反应后,在标准状况下得到11.2 LH2,则下列各组金属中肯定不能构成上述混合物的是( )A.Mg和Al B.Mg和Ag C.Mg和Zn D.Al和Fe
题目
B.Mg和Ag
C.Mg和Zn
D.Al和Fe
相似考题
参考答案和解析
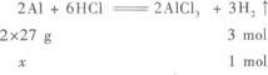
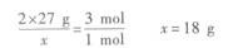
(2)设金属混合物的平均相对原子质量为y(金属均按2价计算),则

即混合物的平均相对原子质量为30.
(3)由两种金属组成的混合物且其平均相对原子质量为30,则其中必有一种金属的相对原子质量大于30,另一种金属的相对原子质量小于30.C选项,Mg为24,Zn为65.D选项,Al看做+2价时,其相对原子质量为18;Fe为56.所以C、D选项均可.A选项,Mg为24,Al为18(+2价时),都小于30,所以A选项是不可能的.B选项,虽然Ag不与盐酸反应,但因Mg可与盐酸反应放出H2,且Mg的相对原子质量小于30,所以Ag与Mg组成的混合物也符合要求.
更多“有两种金属的混合粉末15 g,加入足量的盐酸,充分反应后,在标准状况下得到11.2 LH2,则下列各组金属中肯定不能构成上述混合物的是( )”相关问题
-
第1题:
镁、锌、铁三种金属各30g,分别与足量盐酸反应,生成氢气的质量各是多少?如果反应后各生成氢气30g,则需要这三种金属的质量各是多少?
生成氢气的质量:Mg: 2.5g, Zn: 0.92g, Fe: 1.07g 需要金属的质量:Mg: 360g, Zn: 975g, Fe: 840g -
第2题:
329某一元醇与金属钠完全反应,可得到11.2L氢气(标准状况),则该醇是( )。A.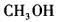
B.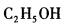
C.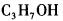
D. 答案:A解析:
答案:A解析: -
第3题:
将8.4 g铁粉跟50 mL盐酸充分混合反应后,有固体剩余,同时收集到1.12 L(标准状况下)H2.原盐酸的物质的量浓度为____________mol/L.答案:解析:2 【解题指要】
(1)铁粉与盐酸混合固体有剩余,即铁粉过量.所以根据反应生成H2的体积,可求得盐酸
中HCl的物质的量.
设50 mL盐酸中HCl的物质的量为xmol,则
所以盐酸的物质的量浓度为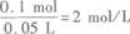

题目已经给出V=0.05 L,所以,只要求得溶质(HCl)的物质的量n代入上式,即可求得c.在
用上式时,应注意V的单位应是“L”,不能用“mL”代入.
(3)Fe与HCl反应的生成物是FeCl2,不是FeCl3.注意不要写错,否则不能得到正确答案. -
第4题:
在相同条件下,等量的()金属与足量盐酸反应生成H2的量最少。
- A、镁
- B、铝
- C、钾
正确答案:C -
第5题:
有两种物质混合而成的白色固体,其焰色反应应为黄色,取少量于试管中,用水溶解,加入盐酸有气泡生成,逸出的气体有臭鸡蛋味,然后加入过量的盐酸,再滴加BaCl2溶液,有白色沉淀生成,试问混合物的组成为什么?并写出有关反应方程式
正确答案:组成为:Na2S,Na2SO4
Na2S+2HCl=2NaCl+H2S↑
Na2SO4+BaCl2=BaSO4↓+2NaCl -
第6题:
将Mg、Al、Zn分别放入相同溶质质量分数的盐酸中,反应完全后,放出的氢气质量相同,其可能原因是()
- A、放入的三种金属质量相同,盐酸足量
- B、放入的Mg、Al、Zn的质量比为12:18:32.5,盐酸足量
- C、盐酸质量相同,放入足量的三种金属
- D、放入盐酸的质量比为3:2:1,反应后无盐酸剩余
正确答案:C -
第7题:
粉末冶金学是指()。
- A、过程中各种原辅料以粉末态参与生产
- B、含金属原料是粉末态的
- C、生产的金属产品是粉末态的
- D、以粉末态的金属或合金为原料,按比例混合均匀后模具成型,在低于金属熔点的温度下烧结固化,以制成金属制品或金属坯
正确答案:D -
第8题:
可溶性还原染料一般是将染料直接加入()的混合液中,再加入金属粉末,如铁粉,则被还原的染料立即被酯化形成()。
正确答案:吡啶和氯磺酸;可溶性还原染料 -
第9题:
单选题在100℃和1.01×105Pa下,在乙炔和某气体X的混合物中加入足量氧气,使之充分反应,只生成CO2(g)和H2O(g)。其中CO2的体积是最初混合气体体积的1.4倍,水蒸气的体积为最初混合气体的1.6倍(体积均在同温同压下测定),则X是()。A乙烯
B乙烷
C甲醇
D甲醛
正确答案: A解析: 设最初混合气体的物质的量为1mol,则n(混):n(C):n(H)=1:1.4:1.6×2,原混合气体的平均分子式为C1.4H3.2。因混合气中有C2H2,要使混合气的组成符合C1.4H3.2,则气体X的碳原子数应小于2,氢原子数应大于或等于4。 -
第10题:
单选题根据金属活动性顺序分析,下列描述或判断错误的是()A常温下,在空气中金属镁比铁容易氧化
B在氧气中灼烧时,铁丝比铜丝反应剧烈
C与同种盐酸反应时,锌片比铁片反应剧烈
D铜活动性不强,故铜不能与硝酸银溶液反应得到金属银
正确答案: D解析: 暂无解析 -
第11题:
问答题A、B两种气态烃,标准状况下A的密度为1.25g/L,将总质量为4.4g的A、B混合气体4.48L(标准状况下)通入足量的溴的四氯化碳溶液中,充分反应后,溴的四氯化碳溶液的质量增加了2.8g.试求A、B是什么气体?正确答案: A:乙烯;B:甲烷解析:
由于标准状况下烃A的密度为1.25g/L,可知A的相对分子质量M=1.25g/L×22.4L=28g/mol,所以A为乙烯;混合气体体积4.48L,即0.2mol,通入足量的溴的四氯化碳溶液中,乙烯被吸收,因为溴的四氯化碳溶液的质量增加了2.8g,可知原气体中含有0.1mol乙烯,另含有0.1mol B气体,质量为1.6g,即B的相对分子质量为16g/mol,即B为甲烷. -
第12题:
单选题46克金属钠在空气中充分燃烧得到淡黄色粉末,该粉末跟水反应放出气体的体积(标况)是( ).A11.2升
B44.8升
C22.4升
D5.6升
正确答案: A解析:
钠在空气中充分燃烧的化学方程式为2Na+O2=Na2O2,46g的Na可以生成78g的Na2O2,然后Na2O2与水反应,2Na2O2+2H2O=4NaOH+O2↑,其中78g的Na2O2 可以生成16g的氧气,氧气的物质的量为0.5mol,所以体积V=0.5×22.4=11.2L. -
第13题:
现有4g由Cu和另一种金属形成的混合物,将其加入足量的稀盐酸充分反应后得到0.2g氢气,则另一种金属是( )。
选项 A B C D Ag Zn Fe Mg 金属活动性顺序 强 K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 弱
正确答案:D
-
第14题:
往50 mL稀硫酸和稀盐酸的混合溶液中加入2.137 5 g氢氧化钡粉末,充分反应后进行过滤,滤液的pH=13,其沉淀干燥后质量为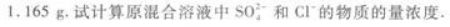 答案:解析:
答案:解析:

(2)H2SO4和HCl的混合溶液中加入Ba(OH)2后,只有H2SO4与其反应生成BaSO4沉淀,所以根据沉淀的质量(即BaSO4的质量)可求出凡(H2SO4).
(3)因滤液的pH=13,可知Ba(OH)2与H2SO4、HCl反应后,仍有剩余.即加入的Ba(OH)2分为三部分:①与H2SO4反应,②与HCl反应,③剩余.根据BaSO4的物质的量可求出H2SO4消
耗的Ba(OH)2,根据剩余溶液的pH=13可求得剩余的Ba(OH)2.所以用Ba(OH)2的总量,减去
H2SO4消耗的量,再减去剩余的量,最后可得与HCl反应的Ba(OH)2的物质的量,并进一步由Ba(OH)2的物质的量求得HCl的物质的量. -
第15题:
一定质量的某铝屑和铁屑的混合物与足量稀硫酸反应后放出氢气8.96L(标准状况),同质量的此混合物与足量的氢氧化钠溶液反应,放出氢气6.72L(标准状况),求混合物中铝和铁的质量.答案:解析:题目中涉及的化学反应如下: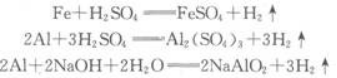

答:原混合物中铝的质量为5.4g,铁的质量为5.6g. -
第16题:
在100℃和1.01×105Pa下,在乙炔和某气体X的混合物中加入足量氧气,使之充分反应,只生成CO2(g)和H2O(g)。其中CO2的体积是最初混合气体体积的1.4倍,水蒸气的体积为最初混合气体的1.6倍(体积均在同温同压下测定),则X是()。
- A、乙烯
- B、乙烷
- C、甲醇
- D、甲醛
正确答案:C -
第17题:
氧乙炔火焰粉末喷焊所采用的热源是氧乙炔火焰,喷焊材料为()。
- A、小颗粒状金属
- B、液态金属
- C、自熔性合金粉末
- D、金属粉末与液态非金属混合物
正确答案:C -
第18题:
下列关于金属钠性质的描述,正确的是()。
- A、金属钠不能直接与硫反应
- B、金属钠在空气中燃烧,生成白色的氧化钠粉末
- C、金属钠能直接与氯气化合
- D、碱金属与氧气在燃烧的情况下反应,生成过氧化钠白色固体
正确答案:C -
第19题:
根据金属活动性顺序分析,下列描述或判断错误的是()
- A、常温下,在空气中金属镁比铁容易氧化
- B、在氧气中灼烧时,铁丝比铜丝反应剧烈
- C、与同种盐酸反应时,锌片比铁片反应剧烈
- D、铜活动性不强,故铜不能与硝酸银溶液反应得到金属银
正确答案:D -
第20题:
填空题钠、镁、铝分别与足量的盐酸反应,在相同状况下产生的氢气的体积相等,则钠、镁、铝三种金属的物质的量之比为____.正确答案: 6∶3∶2解析:
三个反应中金属与氢气的对应比例分别为2Na~H2,Mg~H2,2Al~3H2,所以当氢气的量相同时,钠、镁、铝三种金属的物质的量之比=2∶1∶(2/3)=6∶3∶2. -
第21题:
单选题粉末冶金学是指()。A过程中各种原辅料以粉末态参与生产
B含金属原料是粉末态的
C生产的金属产品是粉末态的
D以粉末态的金属或合金为原料,按比例混合均匀后模具成型,在低于金属熔点的温度下烧结固化,以制成金属制品或金属坯
正确答案: D解析: 暂无解析 -
第22题:
单选题构成合金的两个组元在固态下既不能相互溶解,又不能彼此反应形成化合物,则该合金称为()。A机械混合物合金
B固溶体合金
C金属间化合物
D非晶态合金
正确答案: A解析: 暂无解析 -
第23题:
填空题将54.4g铁和氧化铁的混合粉末投入到适量的稀硫酸中,充分反应后收集到4.48L(标准状况下)氢气并测得溶液中既没有Fe3+也没有固体物质残留,则原混合粉末中铁和氧化铁的质量分别是____g和____g,反应中硫酸消耗掉____mol,反应后得到硫酸亚铁的物质的量是____mol.正确答案: 22.4,32,0.8,0.8解析:
由分析题意可知,最终剩余的铁和三价铁离子恰好完全反应.混合物中的铁的计算分为两部分,一部分是与稀硫酸反应生成氢气,另一部分是和三价铁离子(剩余部分的稀硫酸氧化铁全部转化为三价铁离子)完全反应,生成二价铁离子.
