已知,某原电池的两个半电池都由AgNO3溶液和银丝组成, 其中一个半电池的c(Ag+)=1.0mol/L,另一半电池的c(Ag+)=0.1mol/L,将二者连通后,其电动势为()。A. 0V B. 0.059V C. 0.80V D.无法判断
题目
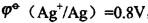 ,某原电池的两个半电池都由AgNO3溶液和银丝组成, 其中一个半电池的c(Ag+)=1.0mol/L,另一半电池的c(Ag+)=0.1mol/L,将二者连通后,其电动势为()。
,某原电池的两个半电池都由AgNO3溶液和银丝组成, 其中一个半电池的c(Ag+)=1.0mol/L,另一半电池的c(Ag+)=0.1mol/L,将二者连通后,其电动势为()。
A. 0V B. 0.059V C. 0.80V D.无法判断
相似考题
参考答案和解析
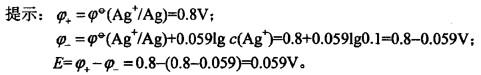
更多“已知,某原电池的两个半电池都由AgNO3溶液和银丝组成, 其中一个半电池的c(Ag+)=1.0mol/L,另一半电池的c(Ag+)=0.1mol/L,将二者连通后,其电动势为()。 ”相关问题
-
第1题:
某原电池符号为: ,向AgN03溶液中通入H2S气体,使Ag+生成Ag2S沉淀,这时原电池的电动势将( )。
,向AgN03溶液中通入H2S气体,使Ag+生成Ag2S沉淀,这时原电池的电动势将( )。
A.增大
B.减小
C.不变
D.不能确定答案:B解析:
-
第2题:
把氧化还原反应Zn+2Ag+Zn2++2Ag组成原电池,欲使该原电池的电动势增大,可采取的措施是()
- A、降低Zn2+浓度
- B、降低Ag+浓度
- C、增加Zn2+浓度
- D、加大Ag电极的表面积
正确答案:A -
第3题:
已知φθAg+/Ag=0.80V,φθZn2+/Zn=-0.76V。将两电对组成原电池,该原电池的标准电动势为()
- A、2.36V
- B、0.04V
- C、0.84V
- D、1.56V
正确答案:D -
第4题:
将铜片插入盛有0.5mol/L的CuSO4溶液的烧杯中,银片插入盛有0.5mol/L的AgNO3,溶液的烧杯中,已知:φθ(Ag+/Ag)=0.7996V, φθ(Cu2+/Cu)=0.337V 求该电池的电动势
正确答案: E = E°- (0.0592/2)Lg([Cu2+]/[Ag+]2) -
第5题:
原电池必须由两个半电池组成,所以将两块锌片分别插入两种不同浓度的ZnSO4溶液中不能组成原电池。()
正确答案:正确 -
第6题:
有一个原电池由两个氢电极组成,其中一个是标准氢电板,为了得到最大的电动势,另一个电极浸入的酸性溶液[设P(H2)=100kPa]应为多少?()
- A、0.1mol˙L-1HCl
- B、0.1mol˙dm-3HAc+0.1mol˙L-1NaAc
- C、0.1mol˙L-1HAc
- D、0.1mol˙L-1H3PO4
正确答案:B -
第7题:
将Zn+Cu2+=Zn2++Cu反应设计为原电池,若在铜半电池溶液中加入氨水后,则电池电动势ε值将()
- A、增大
- B、不变
- C、减小
- D、无法判断
正确答案:C -
第8题:
向原电池(一)Ag,AgCl│Cl-‖Ag+│Ag(+)的负极中加入NaCl,则原电池电动势的变化是:()
- A、变大
- B、变小
- C、不变
- D、不能确定
正确答案:A -
第9题:
在下列原电池中:(-)Zn│ZnSO4(1.0mol/L)‖C、uSO4(1.0mol/L)│C、u(+),如果降低Zn2+的浓 度,其电动势将()。
- A、增大
- B、减小
- C、不变
- D、无法判断
正确答案:A -
第10题:
在原电池Cu∣Cu2+‖Ag+∣Ag中,若使Cu2+浓度降低,则E将(),EΘ将(),电池反应的ΔrGmΘ将()。
正确答案:增大;不变;不变 -
第11题:
问答题组成原电池的两个半电池,半电池A含有1mol/L的甘油酸–3–磷酸和1mol/L的甘油醛–3–磷酸,而另外的一个半电池B含有1mol/LNAD+和1mol/LNADH。回答下列问题: (1)哪个半电池中发生的是氧化反应? (2)在半电池B中,哪种物质的浓度逐渐减少? (3)电子流动的方向如何? (4)总反应(半电池A+半电池B)的ΔE是多少?正确答案: 氧化还原电位ΔEθ的数值愈低,即供电子的倾向愈大,本身易被氧化成为还原剂,另一种物质则作为氧化剂易得到电子被还原。根据该理论判断:
(1)半电池A中发生的是氧化反应;
(2)当甘油醛–3–磷酸被氧化后NAD+减少;
(3)电子由半电池A流向半电池B;
(4)总反应的ΔEθ是+0.23V。解析: 暂无解析 -
第12题:
单选题对于银锌电池(一)Zn|Zn+||Ag+|Ag(+),已知(Zn2+/Zn)=-0.761V,φ(Ag+/Ag)=0.799V,该电池的标准电动势为()A1.180V
B0.038V
C2.369V
D1.56V
正确答案: B解析: 暂无解析 -
第13题:
向原电池(-)Ag,AgCl Cl- Ag+ Ag(+)的负极中加入NaCl,则原电池电动势的变化是:A.变大
B.变小
C.不变
D.不能确定答案:A解析:提示 负极氧化反应:Ag+Cl- =AgCl+e
正极还原反应:Ag++e=Ag
电池反应为:Ag++Cl-=AgCl
原电池负极能斯特方程式为: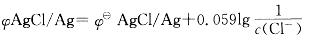
由于负极中加入NaCl,Cl-浓度增加,则负极电极电势减小,正极电极电势不变,
则电池的电动势增大。 -
第14题:
在标准条件下将氧化还原反应Fe2++Ag+Fe3++Ag装配成原电池,原电池符号为()
- A、(-)Fe2+|Fe3+‖Ag+½Ag(+)
- B、(-)Ag|Ag+‖Fe3+½Fe2+(+)
- C、(-)Pt|Fe2+,Fe3+‖Ag+½Ag(+)
- D、(-)Ag|Ag+‖Fe2+,Fe3+½Pt(+)
正确答案:C -
第15题:
将铜片插入盛有0.5mol/L的CuSO4溶液的烧杯中,银片插入盛有0.5mol/L的AgNO3,溶液的烧杯中,已知:φθ(Ag+/Ag)=0.7996V, φθ(Cu2+/Cu)=0.337V写出该原电池的符号
正确答案:(-)Cu│Cu2+(0.5M)‖Ag+(0.5M)│Ag(+) -
第16题:
已知下述电池的电动势为0.18V.已知:φ°(Ag+/Ag)=0.7996V φ°(Cu2+/Cu)=0.34V. 试计算AgBr的Ksp。(-)Ag│AgBr([Br]=0.1mol/L)‖Cu2+(0.1mol/L)│Cu (+)
正确答案:Ksp(AgBr)=1.57×10-12 [已知:φ°(Ag+/Ag)=0.7996V φ°(Cu2+/Cu)=0.34V] -
第17题:
将反应Fe2++Ag+→Fe3++Ag构成原电池,其电池符号为()。
- A、(-)Fe2+∣Fe3+‖Ag+∣Ag(+)
- B、(-)Pt∣Fe2+∣Fe3+‖Ag+∣Ag(+)
- C、(-)Pt∣Fe2+.Fe3+‖Ag+∣Ag(+)
- D、(-)Pt∣Fe2+,Fe3+‖Ag+∣Ag∣Pt(+)
正确答案:C -
第18题:
将反应 Fe3++Cu=Fe2++Cu2+ 组成原电池,在铜半电池中加入氨水,则原电池的电动势会()
- A、减小
- B、增加
- C、不变
- D、先减小后增加
正确答案:B -
第19题:
将铜片插入盛有0.5mol/L的CuSO4溶液的烧杯中,银片插入盛有0.5mol/L的AgNO3,溶液的烧杯中,已知:φθ(Ag+/Ag)=0.7996V, φθ(Cu2+/Cu)=0.337V写出电极反应式和原电池的电池反应
正确答案:电极反应式: (-) Cu2++ 2e-←→ Cu (+) Ag++ e-←→ Ag
电池反应式: Cu+2Ag+←→ 2Ag+Cu2+ -
第20题:
(2013)向原电池(一)Ag,AgCl│Cl-‖Ag+│Ag(+)的负极中加入NaCl,则原电池电动势的变化是:()
- A、变大
- B、变小
- C、不变
- D、不能确定
正确答案:A -
第21题:
某原电池的一个半电池是由金属银片浸在1.0mol·L-1Ag+溶液中组成的,另一半是由银片浸在C(Br-)为1.0mol·L-1的AgBr饱和溶液中组成的,后者为负极,测得电池电动势为0.728V。计算EΘ(AgBr/Ag)=(),KspΘ(AgBr)=()。
正确答案:0.0716V;4.6×10-13 -
第22题:
单选题(2013)向原电池(一)Ag,AgCl│Cl-‖Ag+│Ag(+)的负极中加入NaCl,则原电池电动势的变化是:()A变大
B变小
C不变
D不能确定
正确答案: D解析: 暂无解析 -
第23题:
单选题向原电池(-)Ag,AgCl|Cl-‖Ag+|Ag(+)的负极中加入NaCl,则原电池电动势的变化是( )。[2013年真题]A变大
B变小
C不变
D不能确定
正确答案: D解析:
原电池发生氧化还原反应,负极为:Ag-e-+Cl-=AgCl,正极为:Ag++e-=Ag。根据电极电势的能斯特方程式,有φ=φϴ+0.059lg[1/c(Cl-)]。由于负极中加入NaCl,Cl-浓度增加,则负极电极电势减小,正极电极电势不变,所以原电池的电动势E=φ正-φ负增大。
