湿氯气有漂白、杀菌作用,对大多数金属有强烈腐蚀性,但干燥氯气对金属腐蚀极微的原因()A.氯气属于氧化性气体,不会燃烧、但可助B.氯气和水可发生化学反应:Cl2+H2O→HClO+HClC.次氯酸在受热或光的作用下易分解:HClO→HCl+〔o〕,初生态氧都是氧化剂D.潮湿的氯化氢就时盐酸对金属腐蚀性很强
题目
A.氯气属于氧化性气体,不会燃烧、但可助
B.氯气和水可发生化学反应:Cl2+H2O→HClO+HCl
C.次氯酸在受热或光的作用下易分解:HClO→HCl+〔o〕,初生态氧都是氧化剂
D.潮湿的氯化氢就时盐酸对金属腐蚀性很强
相似考题
更多“湿氯气有漂白、杀菌作用,对大多数金属有强烈腐蚀性,但干燥氯气对金属腐蚀极微的原因() A.氯气属于氧化性气体,不会燃烧、但可助B.氯气和水可发生化学反应:Cl2+H2O→HClO+HClC.次氯酸在受热或光的作用下易分解:HClO→HCl+〔o〕,初生态氧都是氧化剂D.潮湿的氯化氢就时盐酸对金属腐蚀性很强”相关问题
-
第1题:
氯气的杀菌机理为其溶于水后生成的()可分解为HCl和一个新生态的氧[O],[O]是强氧化剂,可以杀菌。A、次氯酸
B、次氯酸盐
C、盐酸
D、氯酸
答案:A
-
第2题:
下列关于氯气的描述中,正确的是( )。
A.氯气以液态形式存在时,可称为氯水或液氯;
B.氯气不能与非金属反应;
C.氯气无毒;
D.氯气有杀菌消毒作用。
正确答案:A
-
第3题:
阅读下列材料,按要求完成教学设计任务。
材料一《普通高中化学课程标准(实验)》内容标准为:“通过实验了解氯、氮、硫、硅等非金属及其重要化合物的主要性质,认识其在生产中的应用和对生态环境的影响”。活动与探究建议:“实验氯气的漂白性”。
材料二某高中化学教科书《化学1》“氯气与水的反应”的教学片段。
目前,很多自来水厂用氯气来杀菌、消毒,我们偶尔闻到的自来水散发出的刺激性气味就是余氯的气味。
氯气溶于水为什么能杀菌消毒呢在25 0C时.1体积的水可溶解约2体积的氯气.氯气的水溶液称为氨水。在常温下,溶于水中的部分Cl2与水发生如下反应: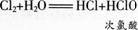
次氯酸(HClO)具有强氧化性,因此,次氯酸能杀死水中的病菌,起到消毒的作用。氯水也因为含有次氯酸而具有漂白作用。
次氯酸是很弱的酸,不稳定,只存在于水溶液中,在光照下易分解放出氧气:
近年来有科学家提出,使用氯气对自来水消毒时,氯气会与水中的有机物发生反应,生成的有机氯化物可能对人体有害。因此,人们已开始研究并试用新的自来水消毒剂。如二氧化氯(C102)、臭氧等。

最初,人们直接用氯气作漂白剂,但因氯气的溶解度不大,而且生成的HCl0不稳定,难以保存,使用起来很不方便,效果也不理想,在C12与水反应原理的基础上,经过多年的实验、改进,才有了今天常用的漂白液和漂白粉。
材料三教学对象为高中一年级学生,他们已经学过了实验的基本方法,物质的量,氧化还原反应.金属及其化合物的相关知识。
要求:
结合上述材料,完成“氯气与水的反应”片段的教学设计,包括教学目标,教学重、难点,教学过程,板书设计(不少于300字)。答案:解析:(1)教学目标 【知识与技能目标】了解氯气与水反应的实质及产物;知道氯水的成分;认识次氯酸的性质和应用。
【过程与方法目标】通过观察、比较化学现象和反应,学会善于从实验中发现问题、分析问题、解决问题的方法。
【情感态度与价值观目标】通过实验激发学习化学的兴趣,树立将化学知识应用于生活、生产的意识。
(2)教学重、难点
【重点】氯气和水的反应、氯水的漂白性。
【难点】氯水的成分和漂白性。
(3)教学过程
环节一:导入新课
创设情景:有时候我们打开水龙头会闻到一股刺激性的气味,这种刺激性的气味来源于氯气,目前有很多自来水都采用氯气来杀菌、消毒,你知道这是为什么吗
导入:今天我们就来探索氯气和水的作用。
环节二:探究新知
对比启迪:我们知道二氧化碳能溶于水,与水反应生成碳酸,氯气能不能溶于水实验表明l体积的水大约溶解2体积的氯气.氯气的水溶液称之为氯水。氯气可以和水反应吗请同学们提出假设或猜想。
提问:如何证明氯气和水发生了反应请大家进行讨论。
【实验探究1】方案l:检验溶液的酸碱性,用玻璃棒蘸取少量的氯水点到紫色石蕊试纸上;方案2:检验氯离子,用胶头滴管吸取少量硝酸银置于小试管中,再用胶头滴管吸取少量氯水滴加到硝酸银溶液里。
请学生进行实验探究1并观察实验现象、得出结论。
设疑:在实验探究l中观察到湿润的蓝色石蕊试纸周围是红色的,它的中间部分是白色的,这意味着氯水中含有漂白性的物质。那氯水中具有漂白性的物质是什么首先我们要知道氯水中都存在哪些离子和分子。请大家根据已有知识进行讨论、推测。
这里我们考虑HCIO(次氯酸)和Cl---2到底是谁具有漂白性呢请学生思考讨论实验方案。
请学生进行实验探究并观察实验现象、得出结论。
【实验探究2】将氯气分别通入盛有干燥的红布条和湿润的红布条的广l:3瓶中,盖上玻璃片。
归纳:干燥的氯气无漂白性.潮湿的氯气有漂白性,所以可得具有漂白性的物质是HClO。
环节三:巩固练习
1.以下物质中,含有氯分子的是()。
A.液氯
B.氯水
C.盐酸
D.食盐
2.能使干燥有色布条褪色的物质是()。
A.氯气
B.氯化氢
C.氯水
D.液氯
环节四:小结作业
小结:这节课我们学习了哪些知识,请同学说一说。学生总结:氯气与水的反应原理,次氯酸的化学性质及应用。
作业:思考如何证明次氯酸的酸性比碳酸弱调研生活生产中还有哪些物质可以作为漂白剂,它们有什么区别
四、板书设计
-
第4题:
干燥氯气对钢铁有强烈的腐蚀作用。
正确答案:错误 -
第5题:
氯气可以消毒是因为氯气()。
- A、具有强氧化性
- B、能和水作用生成一种强氧化剂
- C、有毒
- D、是一种极活泼的非金属单质
正确答案:B -
第6题:
氯气和()可发生化学反应,生产次氯酸和盐酸。
- A、水
- B、酸
- C、化学品
正确答案:A -
第7题:
下列有关氯气叙述不正确的是()
- A、工业上制备氯气是电解饱和食盐水方法制的;
- B、氯气溶于水在光照作用下可得氧气;
- C、氯气是黄绿色又有刺激性气味的有毒气体;
- D、氯气对人体的危害是因为具有强烈的脱水性。
正确答案:D -
第8题:
氯气杀菌,Cl2+H2O→HCl+HOCl→HCl+[O],真正起杀菌作用的是()。
- A、HCl
- B、HOCl
- C、[O]
- D、Cl2
正确答案:C -
第9题:
对氯的杀菌作用的解释是氯与水作用生成的()具有杀菌作用
- A、盐酸
- B、氯气
- C、次氯酸
- D、氯酸
正确答案:C -
第10题:
单选题氯气易溶于水生成次氯酸,对大多数金属有强烈腐蚀性,而干氯 气对于金属的腐蚀性()。A较强
B相等
C极微
D对金属没有腐蚀性
正确答案: D解析: 暂无解析 -
第11题:
单选题对水作氯化消毒时,常用的氯为()和漂白粉。A氯气
B液氯
C次氯酸
D盐酸
正确答案: A解析: 暂无解析 -
第12题:
判断题发生氯气泄漏时不能使用水,因为水和氯反应生成的氯化氢会增大腐蚀性进而加快泄漏率。A对
B错
正确答案: 错解析: 暂无解析 -
第13题:
氯气的化学性质下面( )正确。
A.不能与金属铜发生反应
B.能各和多种金属发生强烈反应
C.氯气遇锑粉会冒火星,紧接着出现白烟
D.氯具有较强的氧化性
正确答案:BCD
-
第14题:
根据下列材料,按要求完成任务。
材料一《普通高中化学课程标准(实验)》关于“非金属及其化合物”的内容标准:通过实验了解氯、氮、硫、硅等非金属及其重要化合物的主要性质.认识其在生产中的应用和对生态环境的影响.?
材料二某版本教科书《化学l》的知识结构体系?
第一章从实验学化学?
第二章化学物质及其变化?
第三章金属及其化合物?
第四章非金属及其化合物?
第一节无机非金属材料的主角——硅?
第二节富集在海中的元素——氯?
第三节硫和氮的氧化物?
第四节氨硝酸硫酸?
材料三某版本高中实验教科书《化学1》中“活泼的黄绿色气体——氯气”的片段:?
氯气的发现和确认?
1774年,瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热.产生了一种黄绿色的气体,有强烈的刺鼻气味。舍勒对这种气体进行了研究,但他受当时流行的学说…一一燃素说(后来证明是错误的)的影响。未能确认这种气体的“庐山真面目”。后来的研究者又被当时得到广泛认同的“一切酸中舍有氧”的观点所束缚。认为舍勒制得的黄绿色气体是“氧化的盐酸”气——一一种氧化物。英国化学家戴维曾通过多种实验想把“氧化的盐酸”,中的“氧”夺取出来,但都未能实现。直到1810年,戴维以大量实验事实为根据,确认“氧化的盐酸”不是一种化合物,而是一种新元素组成的单质,他将这种元素命名为chlorine。这一名称来自希腊文.有“绿色”的意思。中文译名曾为“绿气”,后改为“氯.气.”。
图4-14?瑞典化学家——舍勒(C.?W..Seheele.?1742——1786)
阅读科学史话“氯气的发现和确认”.并思考:?
1.从氯气的发现到确认为一种新的元素.时间长达三十多年。你从这一史实中得到什么启示?
2.舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。请写出舍勒发现氯气的化学反应方程式:?
氯气(Cl2)在通常情况下呈黄绿色,是一种有强烈刺激性气味的有毒气体。与其他气体一样,氯气在低温和加压的条件下可以转变为液态(称为液氯)和固态。氯气是很活泼的非金属单质,具有很强的氧化性。氯气能与大多数金属化合。生成金属氯化物(盐)。例如.钠、铁、铜等都能在氯气中燃烧:?
氯气也能与大多数非金属化合。

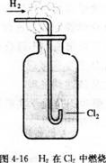
实验4-3
在空气中点燃H2.然后把导管缓缓伸入盛满氯气的集气瓶中。观察现象。

H2与Cl2化合的产物HCl气体溶于水,就成为我们常用的盐酸。

目前,很多自来水厂用氯气来杀菌、消毒,我们偶尔闻到的自来水散发出来的刺激性气味就是余氯的气味。
氯气溶于水为什么能杀菌消毒呢?在25℃时.1体积的水可溶解约2体积的氯气.氯气的水溶液称为氯水。在常温下,溶于水中的部分Cl2与水发生如下反应: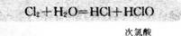
次氯酸(HClO)具有强氧化性,因此。次氯酸能杀死水中的病菌.起到消毒的作用。
氯水也因为含有次氯酸而具有漂白作用。
次氯酸是很弱的酸,不稳定,只存在于水溶液中,在光照下易分解放出氧气:?
近年来有科学家提出,使用氯气对自来水消毒时,氯气会与水中的有机物发生反应,生成的有机氯化物可能对人体有害。因此.人们已开始研究并试用新的自来水消毒剂,如二氧化氯(ClO2)、臭氧等。

氨水的漂白作用?
将有色纸条或布条、有色花瓣放入盛有1/3容积新制氯水的广口瓶中.盖上玻璃片。
观察现象。

干燥的氯气能否漂白物质?
持有色纸条或布条、有色花瓣放入盛满于燥氯气的集气瓶中,盖上玻璃片。观察现象。 ?
?
最初,人们直接用氯气作漂白剂,但因氯气的溶解度不大.而且生成的HClO不稳定,难以保存,使用起来很不方便,效果也不理想。在Cl2与水反应原理的基础上,经过多年的实验、改进,才有了今天常用的漂白液和漂白粉。
在常温下.将氯气通人NaOH溶液中可以得到以次氯酸钠(NaCIO)为有效成分的漂白液。其化学反应方程式如下:?

氯气是一种有毒气体。但可用于自来水的杀菌消毒:使用氯气对自来水消毒时可能产生一些负面影响。因此,人们开始研究并试用一些新型自来水消毒剂。从中你得到什么启示?
要求:?
(1)简要分析教材中该内容的地位和作用。
(2)写出本课的三维教学目标。
(3)设计本节内容的教学过程。答案:解析:(1)氯是比较典型的非金属元素,氯及氯的化合物在日常生活、工农业生产中的应用非常广泛。对氯气性质、用途和制法的研究,不仅是下一节进一步学习、研究卤素性质相似性及其变化规律的需要.也是研究同族元素性质变化规律的需要。由于高中阶段氯气的性质、用途应用较多,对学生全面认识化学元素、形成正确观点、掌握正确学习方法等有重要作用.
(2)教学目标
知识与技能:通过实验观察了解氯气的物理性质和用途.掌握氯气的化学性质。
过程与方法:①通过观察、分析实验现象,培养观察和分析问题的能力;②了解物质性质探究的一般方法——实验探究法;③在学习中,学会运用观察、实验、查阅资料等多种手段获取信息。并运用比较、分类、归纳、概括等方法对信息进行加工。
情感态度与价值观:通过学习,认识到海水是人类宝贵的自然资源。培养与大自然友好相处的情感:联系生活体会氯气给生活带来的变化.培养学习化学的兴趣。
(3)教学过程
导入新课:在日常生活中我们接触的很多东西都涉及氯元素,例如我们输液时的生理盐水.自来水的杀菌消毒都有氯元素的参与。从这节课开始,我们就来学习有关氯及其化合物的知识.
引入:多媒体课件展示与氯气有关的图片.
1.第一次世界大战德军使用氯气;2.京沪高速公路淮安段氯气泄露事件.
学生活动:观看多媒体课件.初步了解和感受氯气的危害.
设问:氯气是怎样被发现的呢
学生活动:学生自主阅读“科学史话”,并写出舍勒发现氯气的化学方程式。
过渡:氯气究竞是一种怎样的物质呢 下面我们就来研究这种气体物质.
展示:向学生展示一瓶刚制备好的氯气.
引导探究:教师引导学生观察、讨论氯气颜色、状态、气味。
设问:闻氯气的正确方法是怎样的
演示:闻氯气时应该用手轻轻地在瓶口扇动,使极少量的氯气飘进鼻孔.
板书:1.氯气的物理性质
黄绿色有毒气体,有刺激性气味,可溶于水(1:2),密度比空气大,熔、沸点较低。易液化。
问题探究:假如你是一名士兵,当遇到由氯气制成的毒气弹顺风爆炸时.你认为可采用哪些措施进行防御
学生回答:1.人躲向地势较高的地方去:2.防毒面具。
过渡:初中我们学习过原子结构示意图的画法,下面请同学们画出氯原子的结构示意图.并借此推测氯原子的性质。
学生活动:学生画出氯的原子结构示意图,通过氯的原子结构推测氯原子性质。
分析:氯原子最外层有7个电子,易得一个电子,使最外层达到8个电子的稳定结构.具有强氧化性。
讲述:结构决定性质,氯原子很活泼,易与另一个原子结合成双原子分子,其单质的性质非常活泼.具有极强的氧化性。下面我们来学习氯气的化学性质.
板书:2.氯气的化学性质
讲述:氯气可以与活泼的金属钠反应,还可以与不太活泼的金属反应.如FeCu等也能在氯气中燃烧生成
设问:氯气可以与金属发生反应,那么氯气能不能与氢气发生反应呢
总结:燃烧不一定要有氧气参加,物质并不是只有在氧气中才可以燃烧,任何发光发热的剧烈化学反应都可以叫燃烧.燃烧的本质是氧化还原反应。
板书:(2)与非金属反应
讲述:实验证明,在一定的条件下,Cl2还可以和P等非金属发生反应。
过渡:你是否偶尔碰到过这样的情形:有时打开水龙头会闻到一股刺激性的气味,你想过这是什么原因吗
设问:氯气是一种有毒的气体,自来水厂为什么还用氯气来杀菌消毒 氯气溶于水为什么能杀菌消毒呢
学生活动:学生讨论提出初步猜想。
实验探究:氯气是否与水发生反应 如果发生了反应一定有新物质生成。我们把氯气溶于水所得的水溶液称为氯水.新制氯水中的成分究竟是什么
学生活动:教师提供仪器和药品(试管2支、胶头滴管2支、新制氯水、紫色石蕊试液、硝酸银溶液、稀硝酸等).学生进行分组实验.通过分组实验验证猜想。
预设方案:验证1:观察氯水论证Cl2分子。
验证2:用紫色石蕊试液测氯水的酸碱性。
验证3:用硝酸银溶液和稀硝酸来检验氯离子。
学生活动:观察实验现象,小组分析讨论,得出结论。
延伸探究:在同学们进行的分组实验中,滴加氯水后石蕊试液为什么先变红后又褪色了呢 是否是Cl2具有漂白性呢
补充实验:取一张红纸,湿润一半投入干燥氯气中。
实验现象:纸条干燥处没有褪色.纸条湿润处褪色了。
师生互动:共同讨论.教师指导,得出结论。
总结:干燥的氯气并无漂白性,真正具有漂白性的物质(使石蕊褪色的物质)不是氯气而是一种新的物质,
讲述:次氯酸具有很强的氧化性.Cl2通入水中会生成次氯酸,能起到杀菌消毒的作用。但同时次氯酸又是很弱的酸.不稳定.只存在于水溶液中.在光照下容易分解。
实验演示:次氯酸光照分解。
讲述:由于Cl2的溶解度不大,而且生成的HClO不稳定,难以保存,使用起来很不方便,效果也不理想。在Cl2与水反应原理的基础上.经过多年的实验、改进,才有了今天常用的漂白粉和漂白液。那么,它们是怎样制得的呢 这个问题我们留到下节课再来进行讨论。
板书设计:
氯气的性质
1.氯气的物理性质
黄绿色有毒气体,有刺激性气味,可溶于水(1:2),密度比空气大,熔、沸点较低,易液化。
2.氯气的化学性质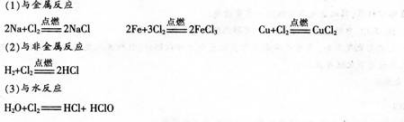
-
第15题:
对水作氯化消毒时,常用的氯为()和漂白粉。
- A、氯气
- B、液氯
- C、次氯酸
- D、盐酸
正确答案:B -
第16题:
湿氯气对钢材具有较强的腐蚀,其腐蚀作用主要是由哪几种物质引起的?()
- A、HclO、ClO-
- B、HClO、ClO-、初生态氧
- C、HclO、ClO-、HCl
- D、HClO、ClO-、HCl、初生态氧
正确答案:D -
第17题:
氯气易溶于水生成次氯酸,对大多数金属有强烈腐蚀性,而干氯 气对于金属的腐蚀性()。
- A、较强
- B、相等
- C、极微
- D、对金属没有腐蚀性
正确答案:C -
第18题:
发生氯气泄漏时不能使用水,因为水和氯反应生成的氯化氢会增大腐蚀性进而加快泄漏率。
正确答案:错误 -
第19题:
湿氯气的化学性质更为强烈,几乎对()有强烈腐蚀作用。
- A、金属
- B、钢铁
- C、钢铁及金属
- D、钢铁及大多数金属
正确答案:D -
第20题:
氯气的危险特性有()。
- A、不会燃烧,但可助燃
- B、能与许多化学品如乙炔、松节油、乙醚、氨、燃料气、烃类、氢气、金属粉末等猛烈反应发生爆炸或生成爆炸性物质
- C、与氟、氯、溴等卤素会剧烈反应
- D、几乎对金属和非金属都有腐蚀作用
正确答案:A,B,D -
第21题:
下列关于氯气的描述中,正确的是()。
- A、氯气以液态形式存在时,可称为氯水或液氯;
- B、氯气不能与非金属反应;
- C、氯气无毒;
- D、氯气有杀菌消毒作用。
正确答案:A -
第22题:
单选题对氯的杀菌作用的解释是氯与水作用生成的()具有杀菌作用A盐酸
B氯气
C次氯酸
D氯酸
正确答案: B解析: 暂无解析 -
第23题:
判断题氯消毒的原理是因为氯气腐蚀性强是强氧化剂,能把致病菌氧化。A对
B错
正确答案: 错解析: 暂无解析
