某化学教师在一次化学测验中设计了下列试题.并对部分学生的考试结果进行了统计和分析。 【试题】有关如图所示化合物的说法正确的是( )。根据上述信息,回答下列问题:? (1)本题的正确答案是__________。 (2)如果你要讲解本题,请写出你的正确解题思路。 (3)请对学生答题错误的原因进行分析和诊断。
题目
某化学教师在一次化学测验中设计了下列试题.并对部分学生的考试结果进行了统计和分析。
【试题】有关如图所示化合物的说法正确的是( )。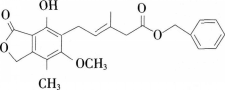

根据上述信息,回答下列问题:?
(1)本题的正确答案是__________。
(2)如果你要讲解本题,请写出你的正确解题思路。
(3)请对学生答题错误的原因进行分析和诊断。
【试题】有关如图所示化合物的说法正确的是( )。


根据上述信息,回答下列问题:?
(1)本题的正确答案是__________。
(2)如果你要讲解本题,请写出你的正确解题思路。
(3)请对学生答题错误的原因进行分析和诊断。
相似考题
更多“某化学教师在一次化学测验中设计了下列试题.并对部分学生的考试结果进行了统计和分析。 ”相关问题
-
第1题:
某化学老师在一次化学测验中设计了下列试题.并对部分学生的解题结果进行了统计和分析。
【试题】利用图6所示装置进行下列实验,能得出相应实验结论的是( )。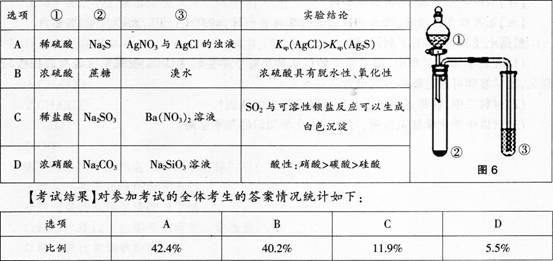
试根据上述信息,回答下列问题:
(1)本题正确的选项是什么
(2)请分析和诊断各个选项解答的错误原因。
(3)如果你要讲评本题,你教给学生的正确解题思路是什么答案:解析:(1)B。 (2)对物质之间发生的反应不清楚,误选A、C。对物质的性质不清楚,误选D。
-
第2题:
某化学老师在一次化学测验中设计了下列试题.并对部分学生的解题结果进行了统计和分析。
【试题】X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为Z2-和Z-,Y+和Z-离子具有相同的电子层结构。下列说法正确的是( )。
A.原子最外层电子数:X>Y>Z
B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z-
D.原子序数:X>Y>Z
【考试结果】对参加考试的全体考生的答案情况统计如下:?
试根据上述信息,回答下列问题:?
(1)本题正确的选项是什么?
(2)请分析和诊断各个选项解答的错误原因。
(3)如果你要讲评本题,你教给学生的正确解题思路是什么?答案:解析:(1)D。
(2)对元素周期表不熟悉,不能根据题意推出X、Y、Z是什么元素。
(3)由X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-.Y+和Z-离子具有相同的电子层结构可推出,X、Y、Z分别为S、Na、F。所以原子最外层电子数Z>X>Y,单质的沸点为Y>X>Z.离子半径:X2->Z->Y+。 -
第3题:
某化学教师在一次化学测验中设计了下列试题.并对学生的解题结果进行了统计和分析。
试根据上述信息.回答问题:
(1)本题正确的选项是什么?(4分)请分别对各选项进行解析。(6分)
(2)学生错选最多的选项是哪个?试分析学生错选的原因。(5分)答案:解析:本题的正确答案是B。
A项,在水中加入酸、碱后会抑制水的电离,酸性(碱性)越强,抑制程度越大。①和②的浓度相同,HCl电离出的氢离子浓度大于CH3COOH电离出的氢离子浓度,①中水的电离程度大;②③④溶液中氢离子和氢氧根离子浓度相同,对水的电离抑制程度相同。故A项错误。
-
第4题:
某化学教师在一次化学测验中设计了下面试题,并对学生的解题结果进行了统计和分析。
下列判断中,正确的是()。
A.甲中反应的平衡常数小于乙
B.该温度下.平衡常数K=400
C.平衡中.丙中c(S03)大于甲中的2倍
D.平衡时,甲中O2的转化率大于乙中O2的转化率。
【考试结果】对参加考试的全体考生的答题情况统计如表3:
试根据上述信息,回答下列问题:
(1)本题正确的选项是什么
(2)请分析和诊断学生解答错误的原因。
(3)如果讲评本题,你如何引导学生形成正确的解题思路答案:解析:
(2)错选成A项的原因:忽略平衡常数只与温度有关,学生可能误认为增大反应物浓度,平衡会正向移动,平衡正向移动,则平衡常数也增大。错选成B项的原因:三段式计算错误,学生在计算K值的时候带入的量不是反应达到平衡时各物质的浓度,而是各物质的物质的量,算出K=400的结果。错选成D的原因:学生认为甲中02的转化率高,可能是没有弄清楚若两种物质发生反应,增加其中一种反应物的浓度,则另一种反应物的转化率升高,自身的转化率降低。
(3)有关化学平衡的计算问题,利用三段式法进行求解,并且注意化学平衡常数只与温度有关,把握好这一点,可以快速计算或者判断平衡常数的大小。要准确判断化学平衡是否发生了移动,需要掌握好温度、浓度、压强等对平衡移动的影响,一般情况下判断的是某一因素对平衡移动的影响,比如浓度或者压强。对于本道题而言整体的分析方法如下:①先利用三段式求解甲中各物质达到平衡时的浓度,进而求解出化学平衡常数(K)的大小,需要明确化学平衡常数(K)只与温度有关,得出A、B两项错误;②接下来比较丙与甲中反应物浓度大小的关系,结合压强对化学平衡移动的影响,得出c正确;③根据反应物浓度对化学平衡移动的影响,得出D错误。 -
第5题:
某化学教师在一次测验中设计了下列测试题.并对学生的解题结果进行了统计和分析。
【试题】25℃时,将pH=6.0的盐酸用水稀释100倍,溶液pH是( )。
A.8
B.7
C.略小于7
D.略小于8 ,
【考试结果】统计学生答案如表l:
表1
根据以上信息,回答下列问题:
(1)本题的正确答案是什么
(2)请写出本题正确的解题思路。
(3)试对学生答题错误的原因进行分析和诊断。答案:解析:(1)C。 (2)正确的解题思路:因为酸度pH与浓度的函数关系图在pH=7的界限附近将呈现出渐近线趋势,但不会跨越pH=7这条界限,而变为碱性。pH=6.0的盐酸溶液加水稀释100倍,溶液无限接近中性,但溶液始终为酸性溶液,反映在pH上,即pH略小于7。
(3)学生选A的原因分析:pH=6.0时,c(H+)=10.6 mol/L。假设原溶液的体积为VL,将原溶液稀释100倍后,体积变为100V L则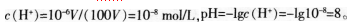
当溶液可能出现无限稀释的情况时,不能再用上述步骤进行计算。
无论盐酸溶液如何稀释,它依然是酸性溶液,无限稀释时也只能趋近于7,即略小于7。而不会等于7。错选B、D两项的原因是:对溶液pH计算方法掌握不清楚,不知道溶液稀释时pH的计算方法,同时不知道无限稀释时溶液的pH变化情况。 -
第6题:
某化学老师在一次化学测验中设计了下列试题,并对学生的解题结果进行了统计分析。?
蒸发1?tool?Br2(1)需吸收30?kJ能量其他相关数据如表1。?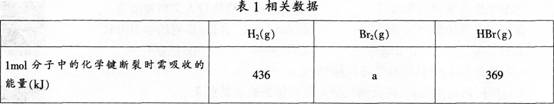
则表中a为( )。?
A.404
B.260
C.230
D.200
【考试结果】有78.3%的同学按下述思路解题而错选A。?
(1)本题正确答案是________(3分),正确解题思路是什么?(6分)
(2)试对学生解题错误形成的原因进行分析。(6分)答案:解析:(1)正确的答案是D。?
正确解题思路:
(2)学生产生错误的原因:学生没有正确理解并掌握△H的计算方法.“△H/=反应物的键能总和一生成物的键能总和=生成物的总能量(焓)一反应物的总能量(焓)”,材料中给出的数据为键能,而不是焓。学生掌握知识是机械的、孤立的,仅知道△H=生成物的总能量(焓)一反应物的总能量(焓),但是却没有正确理解材料中直接给出的是键能而不是焓,没有将键能跟焓的概念区分开,在碰到题目的时候生搬硬套.因此直接得出错误结论。? -
第7题:
某化学教师在一次化学测验中设计了下列试题.并对部分学生的解题结果进行了统计
和分析
【试题】重水(D20)的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-lgc(D+)。下列关于pD叙述正确的是
【考试结果】全体考生的答题情况统计如下: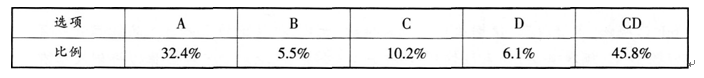
根据上述信息。回答下列问题:
(1)本题的正确答案是什么?(4分)如果你要讲评本题,你教给学生的正确解题思路是什么?(6分)
(2)试对学生解题错误形成的原因进行分析和诊断。(5分)答案:解析: (3)产生错误的原因:选A选项的同学没有理解pH、pD的意义,将常温下中性溶液的pH与pD混淆;选B选项的同学没有注意到重水的离子积与水的不同。
(3)产生错误的原因:选A选项的同学没有理解pH、pD的意义,将常温下中性溶液的pH与pD混淆;选B选项的同学没有注意到重水的离子积与水的不同。 -
第8题:
某化学教师在一次化学测验中设计了下列试题.并对部分学生的考试结果进行了统计和分析。
【试题】在一定条件下.ROn-3和I-发生的离子方程式如下:
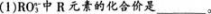
(2)R元素的原子最外层电子数是__________。
【考试结果】60%的学生的答案为(1)R的化合价为6-n;(2)R最外层电子数为5。
试根据上述考试结果回答下列问题:?
(1)本题正确答案为__________,解题思路是__________。
(2)分析学生解题错误可能是由哪些原因造成的。答案:解析:(1)+5、7。解题思路:①根据离子反应电荷守恒思想.可以推断反应前的离子所带电荷总数为一1(因为反应
-
第9题:
某化学教师在一次化学测验中设计了下列试题.并对部分学生的考试结果进行了统计和分析。
【试题】含有amol FeBr2的溶液中,通入xmol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )。
【考试结果】对参加考试的全体考生的答案情况统计如下:
1选项 A B C D
1比例(%) 21.5 40.3 13.6 24.6
试根据上述信息,回答下列问题:
(1)本题正确的选项是什么?
(2)请分析和诊断学生解答错误的可能原因。
(3)如果要你讲评本题,你教给学生的正确的解题思路是什么?答案:解析:(1)B。
(2)错解原因:学生对Fe2+及Br一的还原性的强弱未掌握,不能正确判断不同物质的量的Cl2所能氧化的离子,造成离子方程式书写错误。
(3)解题思路:由于Fe2+的还原性强于Br-.故根据氧化还原反应的先后顺序知.Cl-先氧化
-
第10题:
问答题某化学教师在一次化学测验中设计了下列试题,并对部分学生的考试结果进行了统计和分析。【试题】为了证明烟气中含有二气化碳和一氧化碳,依次通过①澄清的石灰水,②浓硫酸,③炽热的氧化铜,④澄清的石灰水。④中变浑浊的现象说明了什么?【考试结果】部分学生回答有二氧化碳的存在,或者有二氧化碳的生成。试根据上述解题过程及考试结果回答下列问题:(1)本题正确答案是什么?(2)试对学生解题错误的原因进行分析和诊断。(3)如果你要讲评本题,你教给学生的正确的解题思路是什么?正确答案: (1)有二氧化碳的生成,从而证明烟气中含有一氧化碳。
(2)错解原因:没有注意①以及对整个反应流程掌握不到位。
(3)解题思路:澄清石灰水吸收原有的二氧化碳,变浑浊;浓硫酸干燥气体;CO被炽热的氧化铜氧化,生成铜和二氧化碳;生成的二氧化碳通入澄清石灰水,澄清石灰水变浑浊。解析: 暂无解析 -
第11题:
问答题某化学教师在一次化学测验中设计了下列试题,并对部分学生的考试结果进行了统计和分析。 【试题】在一定温度下,将少量的生石灰放入一定量的饱和石灰水中,搅拌并冷却到原来的温度,下列说法正确的是()。 A.溶剂的质量不变 B.溶液中溶质的质量分数不变 C.溶质的质量增加 D.溶液中溶质的质量分数增加 【考试结果】 部分学生答案选A或C。试根据上述考试结果回答下列问题: (1)本题正确答案为__________。 (2)试对学生解题错误的原因进行分析和诊断。 (3)如果你要讲评本题,你教给学生的正确的解题思路是什么?正确答案: (1)B。
(2)错解原因:生石灰放入水中与水发生化学反应生成氢氧化钙,但原来溶液是饱和石灰水,所以生成的氢氧化钙不溶,这一点学生往往能考虑到。对原溶液由于水参加化学反应而质量减少,导致溶液中一部分溶质氢氧化钙也减少认识不到。
(3)解题思路:生石灰放入水中与水发生化学反应生成氢氧化钙,但原来溶液是饱和石灰水,所以生成的氢氧化钙不溶:原溶液由于水参加化学反应,因此溶剂质量减少,因为原溶液是饱和溶液,所以原溶液中的部分溶质会析出,溶质质量减少,但由于仍然是饱和溶液,并且温度没变,所以溶液中溶质的质量分数不变。解析: 暂无解析 -
第12题:
问答题某化学教师在一次化学测验中设计了下列试题,并对部分学生的考试结果进行了统计和分析。 【试题】维生素C(化学式为:C6H8O6)主要存在于蔬菜和水果中,它能促进人体生长发育,增强人体对疾病的抵抗力,近年来研究发现维生素C还有防癌作用。下列关于维生素C的说法中正确的是()。A.维生素C是氧化物B.维生素C中C、H、O三种元素的质量比为12:1:16C.维生素C由6个碳元素、8个氢元素、6个氧元素组成D.维生素C的分子中C、H、O的原子个数比为3:4:3 【考试结果】有40%的学生错选了A和C。 试根据上述信息,回答下列问题: (1)本题正确答案为__________。 (2)分析学生解题错误可能是由哪些原因造成的。 (3)如果你要讲评本题,你教给学生的正确的解题思路是什么?正确答案: (1)D。
(2)错误分析:部分同学看到维生素的分子式为C6H8O6,含有氧元素,就简单地认为是氧化物,对氧化物的概念没有准确掌握;对元素和原子的概念没有掌握。
(3)解题思路:A项,氧化物是由氧元素和另一化学元素组成的二元化合物,维生素C是由碳、氢、氧三种元素组成的纯净物,属于化合物,但不属于氧化物,故A选项说法错误;B项,维生素C中碳、氢、氧三种元素质量比为(12×6):8:(16×6)=9:1:12,故B选项说法错误;C项中,元素是具有相同的核电核数(即核内质子数)的同类原子的总称,物质是由元素组成,分子是由原子构成的,维生素C是由碳元素、氢元素、氧元素组成,故C选项说法错误;D项中,由维生素C的化学式可知,每个维生素分子由6个碳原子、8个氢原子、6个氧原子构成,维生素C的分子中C、H、O的原子个数比为3:4:3,故D选项说法正确;故本题正确答案为D。解析: 暂无解析 -
第13题:
某化学教师在一次化学测验中设计了下列试题.并对部分同学的解题结果进行了统计和分析。
【试题】某同学设计了一个实验方案,用以检验淀粉的水解情况:
结论:淀粉完全没有水解。
讨论上述方案的设计及结论是否正确?请简述理由。
【考试结果】有32.6%的学生提交的错误答案是:设计的方案和结论均正确。因为没有红色沉淀生成,证明溶液中没有水解产物葡萄糖,所以淀粉完全没有水解。
根据以上信息,回答下列问题:
(1)你认为正确的答案是_________。(6分)
(2)试对学生解题错误形成的原因进行分析和诊断。(5分)
(3)请设计一个实验方案,证明淀粉是否完全水解。(4分)答案:解析:(1)正确答案:此方案设计有误,淀粉溶液和稀硫酸混合加热后,在检验水解产物时要先加入氢氧化钠溶液,使溶液显碱性,否则Cu(OH)?2会被多余的硫酸中和,达不到检验的效果。
(2)学生产生错误的原因:学生掌握知识是机械的、孤立的,仅知道淀粉的水解产物会与Cu(OH)2反应,产生砖红色沉淀;但不了解此现象背后的反应是如何发生的,不能从本质上分析化学实验现象,因此直接得出淀粉没有水解的错误结论。
(3)设计如下方案证明淀粉是否完全水解:
①取少量上层清液置于试管中。向试管中加入几滴碘液,若溶液不变蓝则证明已水解完,否则未水解完。②取少量上层清液置于试管中,向试管中加入过量氢氧化钠溶液,使溶液显碱性,加入氢氧化铜缓慢加热,若出现砖红色沉淀.表明淀粉水解;若不出现砖红色沉淀,表明淀粉完全没有水解。 -
第14题:
某化学教师在一次化学测验中设计了下列试题,并对部分学生的考试结果进行了统计和分析。
答题情况如下:选择A的几乎没有,选择B的占72%,选择C的占12%,选择D的占16%。
根据上述信息,回答下列问题:?
(1)本题的正确答案是__________。
(2)如果你要讲解本题,请写出你的正确解题思路。
(3)请对学生答题错误的原因进行分析和诊断。答案:解析:(1)B。
-
第15题:
某化学教师在一次化学测验中设计了下列试题,并对部分学生的考试结果进行了统计和分析。
【试题】下列叙述中,正确的是( )。
根据上述信息.回答下列问题:?
(1)本题的正确答案是____________。
(2)如果你要讲解本题,请写出你的正确解题思路。
(3)请对学生答题错误的原因进行分析和诊断。答案:解析:(1)C。
-
第16题:
某化学教师在一次化学测验中设计了下列试题,并对部分学生的解题结果进行了统计和分析。
【试题】在100 mL某硝酸和硫酸的混合溶液中,硝酸的浓度为0.4 mol·L-1,硫酸的浓度为0.1 mol·L-1,向其中加入1.92g铜片,微热使其充分反映,最终溶液中Cu2+的物质的量浓度为( )
(溶液体积的变化忽略不计,Cu的相对原子质量为64)
A.0.15 mol·L-1
B.0.225 mol·L-1
C.0.3 mol·L-1
D.0.6 mol·L-1
【考试结果】有54.6%的学生错选答案A。
试根据上述信息,回答下列问题:
(1)本题正确的答案是:______。讲评本题时,你教给学生的正确解题思路是______。
(2)试对学生错选答案A的原因进行诊断和分析。答案:解析:(1)B。正确解题思路:首先写出金属铜在混合溶液中发生反应的离子方程式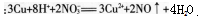 ,根据相关数据计算可以得到溶液中N03-物质的量是0.04mol,H+物质的量是0.06mol,加入铜片物质的量是0.03mol。根据离子方程式进行比较可得到N03-和铜均过量,H+完全反应,那么参加反应的铜的物质的量是
,根据相关数据计算可以得到溶液中N03-物质的量是0.04mol,H+物质的量是0.06mol,加入铜片物质的量是0.03mol。根据离子方程式进行比较可得到N03-和铜均过量,H+完全反应,那么参加反应的铜的物质的量是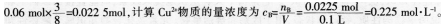 (2)很多同学错选A,是因为学生掌握知识是机械的、孤立的,仅考虑到按照铜与稀硝酸反应方程式
(2)很多同学错选A,是因为学生掌握知识是机械的、孤立的,仅考虑到按照铜与稀硝酸反应方程式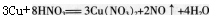 进行计算,由铜片物质的量是0.03mol,硝酸物质的量是0.04mol,就错误地认为参加反应的铜的物质的量是0.015mol,从而计算得到Cu2+物质的量浓度为0.15mol·L-1,而忽略了混合溶液中的硫酸也可以提供H+。
进行计算,由铜片物质的量是0.03mol,硝酸物质的量是0.04mol,就错误地认为参加反应的铜的物质的量是0.015mol,从而计算得到Cu2+物质的量浓度为0.15mol·L-1,而忽略了混合溶液中的硫酸也可以提供H+。 -
第17题:
某化学教师在一次化学测验中设计了下列试题,并对部分学生的考试结果进行了统计和分析。
【试题】含有a tool FeBr2的溶液中,通入xmol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )。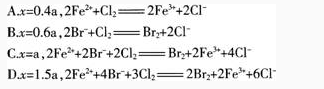
【考试结果】对参加考试的全体考生的答案情况统计如下:
试根据上述信息.回答下列问题:
(1)本题正确的选项是什么?
(2)请分析和诊断学生解答错误的可能原因。
(3)如果要你讲评本题,你教给学生的正确的解题思路是什么?答案:解析:【知识点】化学教学评价能力——氧化性、还原性强弱
(1)B。
(2)错解原因:学生对Fe2+及Br-的还原性的强弱未掌握,不能正确判断不同物质的量的Cl2 所能氧化的离子,造成离子方程式书写错误。
(3)解题思路:由于Fe2+的还原性强于Br-,故根据氧化还原反应的先后顺序知,Cl2先氧化Fe2+然后再氧化Br-。2Fe2+C12=2Fe3++2Cl-,2Br-+C12=Br2+2C1-,2FeBr2+3C12=2FeCl3+ 2Br2。当x/a≤0.5时,Cl2仅氧化Fe2+故A项正确。当x/a≥1.5时,Fe2+和Br全部被氧化,D项正确;当介于两者之间时,则要分步书写方程式,然后进行叠加得总反应。如B项,当x=0.5a时,Cl2刚好把Fe2+全部氧化,而当x=0.6a,显然Cl2还要氧化Br-,而选项中没有表示,故B项错误。 -
第18题:
某化学教师在一次化学测验中设计了下面试题,并对学生的解题结果进行了统计和 分析。
【试题】A、B、C、D、E是五种短周期元素,A、B、C、E同周期,c、D同主族,A元素在地壳含量中排名第二,B是同周期第一电离能最小的元素,C原子的最外层有三个未成对电子,E单质常温下为淡黄色固体。
判断B、C、E第一电离能由大到小的顺序是什么(用元素符号作答)
【考试结果】参加考试的全体考生的答题情况统计如下:
试根据上述信息.回答下列问题:
(1)本题的正确答案是什么
(2)试分析学生得分偏低的可能原因。
(3)如果要你讲评本题,你教给学生的正确解题方法是什么答案:解析:(1)本题正确答案为P>S>Na。通过对题干进行分析,根据已知条件能够推断出A元素为Si,B元素为Na,C元素为P,E元素为S。再依据第一电离能大小关系判断出P>S>Na。 (2)一方面多数学生对第一电离能大小关系判断理解不透彻,即忽略同周期内VA>VIA的反常现象。因此在判断同周期这三种元素第一电离能大小关系时,没有想到这一点,只根据同周期内随原子核电荷数的增加,电离能增大的规律来进行判断;另一方面极少部分学生,对第一电离能大小关系判断方法本身不清楚,记忆有偏差,即认为同周期随原子核电荷数增加,第一电离能减小,也是造成错误的原因之一。
(3)在判断第一电离能大小时,具有以下的变化规律:同一主族的原子,从上到下,原子核对外层电子的吸引力减小,电离能逐渐减小。同周期的原子,从左到右,原子核对外层电子的吸引力增加,电离能随之增加。但存
-
第19题:
某化学教师在一次测验中设计了下列试题,并对部分学生的问题结果进行了设计和分析。
【试题】Na2S03暴露于空气中容易变质,某学生按照如下方案计算Na2S03,样品的纯度:
①准确称取样品w g于小烧杯中,加入适量蒸馏水配成溶液;②向小烧杯中滴入 ;
溶液直至沉淀完全;(③将沉淀、称重,得沉淀为a g;④计算Na2S03样品的纯度。
【考试结果】有约20%的学生提交了下面的答案:②向小烧杯中滴入HN03酸化的Ba(N03):
溶液直至沉淀完全;③将沉淀过滤、干燥、称重,得沉淀为a g。
问题:
(1)本题的正确答案是:②向小烧杯中滴入溶液直至沉淀完全;③将沉淀、称重,得沉淀为a g。
(2)试对【考试结果】中学生答题错误原因进行分析和诊断。
(3)写出Na2S03样品在空气中变质的化学反应方程式。答案:解析:(1)盐酸酸化的BaCl:溶液;过滤、干燥。 解析:Na2S03在空气中变质生成Na2S04,加入盐酸酸化的BaCl2溶液可以生成不溶于酸的Ba2S04沉淀,根据生成的Ba2S04沉淀可计算样品中Na2S04的质量,从而计算得到Na2S03样品的纯度。因此需要过滤、干燥来得到沉淀。
(2)答题错误原因分析:学生知道利用不溶解于稀硝酸的BaS04沉淀来检验SO42-但忽略了硝酸的强氧化性可以把Na2S03氧化为Na2S04,因此加入HN03酸化的Ba(N03)2溶液会导致Na2S03与Na2S04均转化为BaS04沉淀。
(3) 解析:Na2S03在空气中变质生成Na2S04是因为氧气的氧化作用。
解析:Na2S03在空气中变质生成Na2S04是因为氧气的氧化作用。 -
第20题:
某化学教师在一次教学中设计了下列试题,并对部分学生的解题结果进行了统计和分析。
【试题】某温度下,100 9饱和氯化钠溶液中含有氯化钠26.5 g。若向此溶液中先加入6.5 g水,再添加3.5 g氯化钠,则所得溶液的质量分数为( )。
A.30%
B.27-3%
C.26.5%
D.28.2%
【考试结果】对参加考试的全体考生的答题情况统计如表1:
表1
试根据上述信息,回答下列问题:
(1)本题正确的选项是 。
(2)如果你要讲评本题,你教给学生的正确解题思路是什么
(3)试对造成学生解题错误的可能原因进行分析。答案:解析:(1)C。 (2)正确解题思路:首先根据已知条件得出氯化钠在此温度下的饱和溶液的质量分数为26.5%,再据此判断6.5 g水最多能溶解多少克氯化钠.由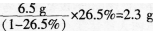 得出加入的6.5 g水最多能溶解2.3 g氯化钠,加入的3.5 9氯化钠不能完全溶解。因此最后仍然得到饱和溶液,浓度为26.5%。
得出加入的6.5 g水最多能溶解2.3 g氯化钠,加入的3.5 9氯化钠不能完全溶解。因此最后仍然得到饱和溶液,浓度为26.5%。
(3)本题有很多学生误选B。原因是没有根据氯化钠在此温度下的溶解度去判断加入的3.5 g氯化钠是否能够完全溶解.故得出错误答案:其他误选A、D两项的学生可能是因为对溶解度的含义理解错误,或者对溶质质量分数的计算公式没有掌握等原因造成。 -
第21题:
某化学教师在一次化学测验中设计了下列试题,并对部分学生的考试结果进行了统计?
和分析。把aL硫酸铵和硝酸铵的混合液分成两等份,一份加入b?mol烧碱并加热,刚好把NH3全部赶出。另一份需消耗c?mol?BaCl2,沉淀反应刚好完全,原溶液中硝酸根离子的物质的量浓度为( )。
上面是某学校化学测试中的一道题.不少学生会错选A项。
回答下列问题:?
(I)本题正确答案是什么?
(2)分析学生可能出现的解题错误原因。
(3)如果你要测评本题,你教给学生的正确解题思路得什么?答案:解析:(1)D。
-
第22题:
问答题某化学教师在一次化学测验中设计了下列试题,并对部分学生的考试结果进行了统计和分析。 【试题】现有Cu、Cu(OH)2、Fe2O3、BaCO3、AgNO3溶液、盐酸,若各取少量两两混合,可以发生的化学反应共有________个,其中有________个反应可以生成水,有________个反应属于置换反应。 【考试结果】部分学生错解答案为可发生的化学反应有4个,其中有2个反应可以生成水,有1个反应属于置换反应。 试根据上述考试结果回答下列问题: (1)本题正确答案为____。 (2)如果你要讲评本题,你教给学生的正确的解题思路是什么? (3)分析学生解题错误可能是由哪些原因造成的。 (1)5;3;1。正确答案: (2)解题思路:Cu和AgNO可发生置换反应。根据复分解反应的条件知Cu(OH)2、Fe2O3、BaCO3、AgNO3溶液都能和盐酸发生复分解反应。因Cu(OH)2和BaCO都是难溶于水的物质,Cu(OH)、BaCO3、AgNO3溶液三者之间不能反应。
(3)错解原因:误认为碳酸钡不溶于水,不能与盐酸发生复分解反应。解析: 暂无解析 -
第23题:
问答题某化学教师在考试中设计了下列试题,并对部分学生的考试结果进行了统计和分析。【试题】有混合气体CO2、H2O(g)、H2、O2、N2、CO等,依次通过①灼热的铜丝,②澄清的石灰水,⑧灼热的氧化铜,④浓硫酸,最后剩下的气体是什么?【考试结果】部分学生会这样分析:过程①吸收O2;过程②吸收CO2;过程③吸收H2和CO;过程④吸收H2O(g),所以最后只剩下N2。试根据上述解题过程及考试结果回答下列问题:(1)本题正确答案为_______________。(2)如果你要讲评本题,你教给学生的正确的解题思路是什么?(3)试对学生解题错误的原因进行分析和诊断。正确答案: (1)CO2和N2
(2)解题思路:过程
①吸收O2;过程②吸收CO2;过程③吸收H2和CO,但放出CO2;过程④吸收H2O(g),所以最后剩下的气体应是CO2和N2。
(3)错解原因:学生忽略了灼热的氧化铜吸收CO的同时还会产生CO2。解析: 暂无解析
