新药进行临床试验必须提供A.系统药理研究数据 B.急慢性毒性观察结果 C.新药作用谱 D.LD.50 E.临床前研究资料
题目
B.急慢性毒性观察结果
C.新药作用谱
D.LD.50
E.临床前研究资料
相似考题
参考答案和解析
更多“新药进行临床试验必须提供”相关问题
-
第1题:
临床试验分为I、Ⅱ、Ⅲ、Ⅳ期,申请新药注册时
A.必须进行I、Ⅱ、Ⅲ、Ⅳ期临床试验
B.可以只进行I、Ⅱ期临床试验
C.可以只进行Ⅱ、Ⅲ期临床试验
D.可以只进行Ⅲ、Ⅳ期临床试验
E.可以只进行Ⅱ、Ⅳ期临床试验
正确答案:C
-
第2题:
新药申请注册程序的主要步骤是A.新药非临床试验申请、新药临床试验申请
B.新药非临床试验申请、新药生产申请
C.新药非临床试验申请、新药临床试验申请、新药生产申请
D.新药生产申请
E.新药临床试验申请、新药生产申请答案:E解析:新药申请是指未曾在中国境内上市销售的药品的注册申请。已上市药品改变剂型、改变给药途径、增加新适应症的药品注册按照新药申请程序申报。申请新药注册所报送的资料应当完整、规范、数据必须真实、可靠;引用文献资料应当注明著作名称、刊物名称及卷、期、页等;未公开发表的。新药申请注册程序的主要步骤是新药临床试验申请(IND)、新药生产申请(NDA)。 -
第3题:
新药进行临床试验必须提供A.系统药理研究数据
B.急慢性毒性观察结果
C.新药作用谱
D.LD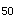
E.临床前研究资料答案:E解析: -
第4题:
关于药物的临床试验叙述正确的是A.须经国家药监局批准,必须执行《药物临床试验质量管理规范》
B.临床试验分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期
C.新药在批准上市前,应当进行Ⅰ、Ⅱ、Ⅲ期临床试验
D.Ⅲ期为治疗作用确证阶段答案:A,B,C,D解析:临床试验是决定候选药物能否成为新药上市销售的关键阶段,这一阶段必须获得国家药物监督管理部门的批准在具有临床药物临床试验资格的机构中实施,并严格遵守《药物临床试验质量管理规定》的规定。临床试验分为Ⅰ、Ⅱ、Ⅲ、Ⅳ期。新药在批准上市前,申请新药注册应当完成Ⅰ、Ⅱ、Ⅲ期临床试验。Ⅲ期为治疗作用确证阶段。故选ABCD。 -
第5题:
在开始新药临床试验之前,研究者必须送交伦理委员会哪些文件?
正确答案: 1)SFDA药物临床试验批件;
2)初步试验方案或方案修改;
3)研究者手册及临床前研究资料;
4)知情同意书样本及其的修改;
5)药检报告;
6)病例报告表样本;
7)其他(如招募受试者广告、向受试者提供的其他书面材料等);
8)多中心试验,需有各参加研究单位及主要研究者名单,组长单位伦理委员会批件;
9)申办方的经营许可证、生产许可证、GMP证书和工商营业执照;
10)法律责任的承诺;
11)其他相关资料。 -
第6题:
观察人体对新药的耐药程度和药代动力学,为制定给药方案提供依据:()
- A、Ⅰ期临床试验
- B、Ⅱ期临床试验
- C、Ⅲ期临床试验
- D、Ⅳ期临床试验
正确答案:A -
第7题:
新药申请注册程序的主要步骤是()
- A、新药非临床试验申请、新药临床试验申请
- B、新药非临床试验申请、新药生产申请
- C、新药非临床试验申请、新药临床试验申请、新药生产申请
- D、新药生产申请
- E、新药临床试验申请、新药生产申请
正确答案:E -
第8题:
新药临床试验必须符合()
- A、GAP
- B、GLP
- C、GCP
- D、GMP
- E、GSP
正确答案:C -
第9题:
新药进行临床试验必须提供()
- A、系统药理研究数据
- B、急、慢性毒性观察结果
- C、新药作用谱
- D、LD50
- E、临床前研究资料
正确答案:E -
第10题:
新药申请注册必须进行临床试验。
正确答案:正确 -
第11题:
单选题新药进行临床试验必须提供()A系统药理研究数据
B急、慢性毒性观察结果
C新药作用谱
DLD50
E临床前研究资料
正确答案: A解析: 暂无解析 -
第12题:
单选题新药临床试验必须符合()AGAP
BGLP
CGCP
DGMP
EGSP
正确答案: E解析: 暂无解析 -
第13题:
目的是观察人体对于新药的耐受程度和药代动力学。为制定给药方案提供依据的是A.I期临床试验SXB目的是观察人体对于新药的耐受程度和药代动力学。为制定给药方案提供依据的是
A.I期临床试验
B.Ⅱ期临床试验
C.Ⅲ期临床试验
D.Ⅳ期临床试验
E.生物等效性试验
正确答案:A
略 -
第14题:
新药临床评价的分期,新药获得批准试生产后进行的扩大化临床试验阶段,进一步验证药物对目标适应证患者的治疗作用和安全性,评价利益和风险关系,最终为药物注册申请获得批准提供充分的依据,属于A.Ⅰ期临床试验
B.Ⅱ期临床试验
C.Ⅲ期临床试验
D.Ⅳ期临床试验
E.Ⅴ期临床试验答案:C解析:Ⅲ期临床试验:新药获得批准试生产后进行的扩大化临床试验阶段,进一步验证药物对目标适应证患者的治疗作用和安全性,评价利益和风险关系,最终为药物注册申请获得批准提供充分的依据。 -
第15题:
以下关于药物临床研究的说法正确的是A.临床研究包括临床试验或生物等效性试验
B.申请新药注册应进行临床试验或生物等效性试验
C.临床试验分四期
D.申请新药可进行Ⅰ、Ⅱ、Ⅲ期临床试验,有时可进行Ⅱ、Ⅲ期或Ⅲ期临床试验答案:A,B,C,D解析:临床研究包括临床试验或生物等效性试验,申请新药注册应进行临床试验或生物等效性试验。临床试验分四期,申请新药可进行Ⅰ、Ⅱ、Ⅲ期临床试验,有时可进行Ⅱ、Ⅲ期或Ⅲ期临床试验。Ⅳ期临床试验是新药上市后的应用研究阶段。故选ABCD。 -
第16题:
新药临床试验必须符合()
AGAP
BGLP
CGCP
DGMP
EGSP
C
略 -
第17题:
下述不正确的是()
- A、研究者在临床试验前必须获得药品监督管理部门批准进行临床试验的批文
- B、研究者在临床试验前必须获得药检部门对准备用于人体试验的该批新药的质量检验合格证明
- C、研究者在临床试验前必须审查全部研究资料
- D、研究者在临床试验前必须熟悉申办者所提供的与临床试验有关的资料与文献
- E、参加研究的医师不需要掌握研究计划内容与要求
正确答案:E -
第18题:
新药研制单位向国家食品药品监督管理局药品评审中心进行注册申请和技术评审必须呈报的内容之一,也是新药评价的最后阶段的是:()
- A、新药临床前研究
- B、新药临床试验Ⅰ期
- C、新药临床试验Ⅱ期
- D、新药临床药理评价
正确答案:D -
第19题:
观察人体对于新药的耐受程度和药代动力学,为制定给药方案提供依据的是()
- A、Ⅰ期临床试验
- B、Ⅱ期临床试验
- C、Ⅲ期临床试验
- D、Ⅳ期临床试验
正确答案:A -
第20题:
新药进行临床试验必须提供?()
- A、系统药理研究数据
- B、慢性毒性实验结果
- C、LD50
- D、临床前研究资料
- E、核算药物成本
正确答案:A,B,C,D -
第21题:
新药在批准上市前,申请新药注册应当进行()
- A、I、Ⅱ、Ⅲ、Ⅳ期临床试验
- B、I、Ⅱ、Ⅲ期临床试验
- C、Ⅱ、Ⅲ期临床试验
- D、Ⅲ、Ⅳ期临床试验
正确答案:B -
第22题:
单选题下述不正确的是()A研究者在临床试验前必须获得药品监督管理部门批准进行临床试验的批文
B研究者在临床试验前必须获得药检部门对准备用于人体试验的该批新药的质量检验合格证明
C研究者在临床试验前必须审查全部研究资料
D研究者在临床试验前必须熟悉申办者所提供的与临床试验有关的资料与文献
E参加研究的医师不需要掌握研究计划内容与要求
正确答案: E解析: 暂无解析 -
第23题:
多选题新药进行临床试验必须提供:A急性毒性观察结果
B药物的成本
C慢性毒性观察结果
D系统药理研究数据
E临床前研究资料
正确答案: C,B解析: 暂无解析 -
第24题:
多选题新药进行临床试验必须提供?()A系统药理研究数据
B慢性毒性实验结果
CLD50
D临床前研究资料
E核算药物成本
正确答案: C,E解析: 暂无解析
