1、由于焓变的单位是kJ∙mol-1,所以热化学方程式的系数不影响反应的焓变值。
题目
1、由于焓变的单位是kJ∙mol-1,所以热化学方程式的系数不影响反应的焓变值。
相似考题
参考答案和解析
更多“1、由于焓变的单位是kJ∙mol-1,所以热化学方程式的系数不影响反应的焓变值。”相关问题
-
第1题:
汽轮机的进汽焓值为3432.97kj/kg,排气焓值为2437.14kj/kg,1kg再热蒸汽带给汽轮机的热量为500.03kj/kg,高压缸第1级抽气的焓值为3139.26kj/kg,则第1级抽气的做功不足系数Y1为( )。A.0.8037
B.0.8526
C.0.8809
D.0.9125答案:A解析: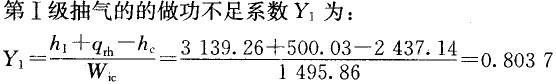
-
第2题:
一位化学教师正在教授“化学反应原理”这个模块,他在备课的过程中发现新教材引入了焓变的概念.于是他产生了一个疑问:既然焓变的大小等于等压过程反应热,那么既然已经给学生建立了反应热的认识.为什么还要引入“焓变”呢?(1)请写出焓的定义式,并说明其含义。(2)为什么有了反应热,还需要引入焓变?它的作用是什么?
正确答案: (1)H=U+pV,U是体系的内能,p是体系的压强,V是体系的体积。由于我们不能确定体系内能的绝对值,所以也不能确定焓的绝对值。焓是状态函数,具有能量量纲,但是没有明确的物理意义。焓完全是化学家为了便于计算特定条件下的反应热而定义出的一个体系的热力学性质。
(2)等压过程的反应热(Q)是可以通过实验测量的,但每一个反应的Q都必须通过实验测量;引入焓变后,可以利用盖斯定律通过焓变的计算得到没有经过实验测定的反应的反应热;焓变是状态函数,在此基础上定义的物质的标准生成焓,具有重要意义。 -
第3题:
已知某对行反应的反应焓为-150kJ・mol-1则该正反应的活化能为()
- A、低于150kJ•mol-1
- B、高于150kJ•mol-1
- C、等于150kJ•mol-1
- D、无法确定
正确答案:B -
第4题:
单质和化合物的相对焓值,规定在标准状态时由指定单质生成单位物质的量的纯物质时反应的焓变叫做该物质的()。
正确答案:标准摩尔生成焓 -
第5题:
已知乙醇的标准摩尔燃烧焓(C2H5OH,298)=-1366.95kJ·mol-1,则乙醇的标准摩尔生成焓(298)=()。
正确答案:-277.56 -
第6题:
已知反应N2(g)+H2(g)=2NH3(g)的标准摩尔焓变为-92.22KJ·mol-1,下列哪一数据为NH3(g)的标准摩尔生成焓()
- A、-46.11KJ·mol-1
- B、-92.22KJ·mol-1
- C、46.11KJ·mol-1
- D、92.22KJ·mol-1
正确答案:A -
第7题:
在标准条件下石墨燃烧反应的焓变为-393.7kJ·mol-1,金刚石燃烧反应的焓变为-395.6kJ·mol-1,则石墨转变为金刚石反应的焓变为()kJ·mol-1。
- A、-789.3
- B、0
- C、1.9
- D、-1.9
正确答案:C -
第8题:
已知25℃时,C石+O2=CO2(g)的标准摩尔反应焓为ΔrH9m,1=-390kJ·mol-1; 2CO(g)+O2=2CO2(g)的标准摩尔反应焓为ΔrH9m,2=-566kJ·mol-1 则CO(g)的标准摩尔燃烧焓ΔcH9m=(); 2CO2(g)的标准摩尔生成焓为ΔfH9m=()。
正确答案:-283kJ·mol-1;-390kJ·mol-1 -
第9题:
戊烷的标准摩尔燃烧焓为-3520kJ·mol-1,CO2(g)和H2O(l)的标准摩尔生成焓分别为-395 kJ·mol-1和-286 kJ·mol-1,则戊烷的标准摩尔生成焓为()。
- A、2839kJ·mol-1
- B、-2839kJ·mol-1
- C、171kJ·mol-1
- D、-171kJ·mol-1
正确答案:D -
第10题:
某物质B的标准摩尔燃烧焓为ΔcH9m(298.15K)=-200kJ·mol-1,则该物质B在298.15K时燃烧的反应标准摩尔焓变ΔrH9m为()
- A、–200kJ·mol-1
- B、0kJ·mol-1
- C、200kJ·mol-1
- D、40kJ·mol-1
正确答案:A -
第11题:
单选题压缩制冷装置假设管路中冷剂焓值不变,若压缩机进口焓值为420kJ/kg,压缩机出口焓值为475kJ/kg,冷凝器出口焓值为250kJ/kg,则单位制冷量和单位排热量为()kJ/kg和()kJ/kg。A55,170
B170,225
C170,280
D225,280
正确答案: B解析: 暂无解析 -
第12题:
单选题压缩制冷装置假设管路中冷剂培焓值不变,若压缩机进口焓值为400kJ/kg,压缩机出口焓值为450kJ/kg,冷凝器出口焓值为250kJ/kg,则制冷系数为()。A3
B4
C5
D不可求
正确答案: A解析: 暂无解析 -
第13题:
化学反应在任何温度下都不能自发进行时,其()
- A、焓变和熵变两者都是负的;
- B、焓变和熵变两者都是正的;
- C、焓变是正的,熵变是负的;
- D、焓变是负的,熵变是正的.
正确答案:C -
第14题:
已知H2(g)+ 1/2O2(g)→ H2O(g),ΔrHmθ(298.15K)= -241.818 kJ·mol-1所以说,H2的标准摩尔燃烧焓为ΔcHmθ(298.15K)= -241.818kJ·mol-1
正确答案:正确 -
第15题:
对于热化学反应方程,表述正确的有()
- A、不同组分表示的化学反应进度相同
- B、反应进度与方程式书写无关
- C、化学反应焓变与方程式书写形式无关
- D、化学反应摩尔焓变与反应方程式书写形式无关
正确答案:A,D -
第16题:
已知H2O(l)的标准生成焓=-286kJ·mol-1,则反应H2O(l)→H2(g)+O2(g),在标准状态下的反应热效应=(),氢气的标准摩尔燃烧焓=()。
正确答案:286;-286 -
第17题:
石墨和金刚石的燃烧热分别是394和396KJ·mol-1, 那么金刚石的标准生成焓为()
- A、–790 kJ·mol-1
- B、2kJ·mol-1
- C、+790 kJ·mol-1
- D、–2 kJ·mol-1
正确答案:D -
第18题:
由于焓的绝对值不可知,所以化学反应焓变的绝对值也不可知。
正确答案:错误 -
第19题:
热是()的一种形式,系统吸热,Q()0;系统放热,Q()0;定压下气体所做的体积功W=();气体膨胀时,体积功W<0。若NaOH溶液与HCl溶液正好中和时,系统的焓变ΔrHΘ=akJ·mol-1,则其热力学能的变化ΔrUΘ=()kJ·mol-1。这是一个()相反应。
正确答案:能量传递;>;<;-pex(V2-V1);a;均(单) -
第20题:
双分子气相反应A + B = D,其阈能为50.0 kJ·mol-1,反应在400K时进行,该反应的活化焓 ΔrH≠m为()
- A、46.674 kJ·mol-1
- B、48.337 kJ·mol-1
- C、45.012 kJ·mol-1
- D、43.349 kJ·mol-1
正确答案:C -
第21题:
双分子气相反应A+B=D,其阈能为50.0kJ•mol-1,反应在400K时进行,该反应的活化焓△≠rHm为()。
- A、46.674kJ•mol-1
- B、48.337kJ•mol-1
- C、45.012kJ•mol-1
- D、43.349kJ•mol-1
正确答案:C -
第22题:
单选题在标准条件下石墨燃烧反应的焓变为-393.6kJ•mol-1,金刚石燃烧反应的焓变为-395.5kJ•mol-1,则石墨转变成金刚石反应的焓变为()。A-789.3kJ•mol-1
B0kJ•mol-1
C+1.9kJ•mol-1
D-1.9kJ•mol-1
正确答案: B解析: 暂无解析 -
第23题:
填空题在标准状态下的反应H2(g)+Cl2(g)→2HCl(g),其ΔrHmθ=-184.61kJ•mol-1,由此可知HCl(g)的标准摩尔生成焓变应为()kJ•mol-1正确答案: -92.30kJ.mol-1解析: 暂无解析 -
第24题:
单选题压缩制冷装置假设管路中冷剂的焓值不变,若压缩机进口焓值为400kJ/kg,压缩机出口焓值为450kJ/kg,冷凝器出口焓值为250kJ/kg,则制冷系数为:()。A3
B4
C5
D不可求
正确答案: B解析: 暂无解析
