将反应式2MnO4- +10Fe2++ 16H+ == 2Mn2+ + 10Fe3++ 8H2O设计成原电池,下列原电池的表示式正确的是A.(-) Pt | Fe2+, Fe3+|| Mn2+, MnO4-, H+ | Pt ()B.(-) Mn | MnO4-, Mn2+, H+ || Fe2+, Fe3+| Mn ()C.(-) Fe | Fe2+, Fe3+|| Mn2+, MnO4-, H+ | Mn ()D.(-) Pt | MnO4-, Mn2+, H+ || Fe2+, Fe3+| Mn (
题目
将反应式2MnO4- +10Fe2++ 16H+ == 2Mn2+ + 10Fe3++ 8H2O设计成原电池,下列原电池的表示式正确的是
A.(-) Pt | Fe2+, Fe3+|| Mn2+, MnO4-, H+ | Pt ()
B.(-) Mn | MnO4-, Mn2+, H+ || Fe2+, Fe3+| Mn ()
C.(-) Fe | Fe2+, Fe3+|| Mn2+, MnO4-, H+ | Mn ()
D.(-) Pt | MnO4-, Mn2+, H+ || Fe2+, Fe3+| Mn ()
相似考题
更多“将反应式2MnO4- +10Fe2++ 16H+ == 2Mn2+ + 10Fe3++ 8H2O设计成原电池,下列原电池的表示式正确的是”相关问题
-
第1题:
两个电极组成原电池,下列叙述正确的是( )。
 答案:D解析:原电池中电极电势E值大的是正电极,E值小的是负电极。
答案:D解析:原电池中电极电势E值大的是正电极,E值小的是负电极。 -
第2题:
下列各装置中,能构成原电池的是:
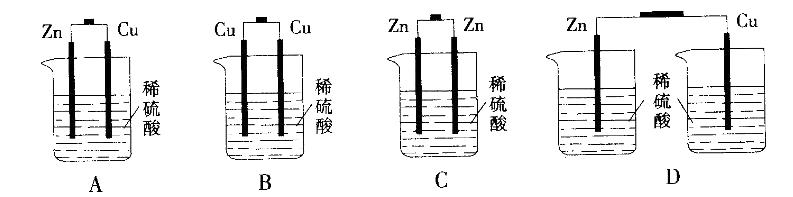 答案:A解析:原电池是利用两个电极之间金属性的不同,发生氧化还原反应,从而使电子的流动,产生电流。故电池两极金属不同,且在同一个烧杯中。故答案选A。
答案:A解析:原电池是利用两个电极之间金属性的不同,发生氧化还原反应,从而使电子的流动,产生电流。故电池两极金属不同,且在同一个烧杯中。故答案选A。 -
第3题:
下列各项中,属于消费税征收范围的有( )。A. 无汞原电池
B. 燃料电池
C. 锂原电池
D. 涂料答案:A,B,C,D解析:上述选项均属于消费税征收范围 -
第4题:
下列说法中错误的是()。
- A、原电池正极发生还原反应,负极发生氧化反应
- B、原电池中氧化剂在原电池的正极
- C、原电池的电池反应就是作为氧化剂的物质同作为还原剂的物质起反应
- D、原电池中,电极电位较低的电对组成电池的正极
正确答案:D -
第5题:
原电池必须由两个半电池组成,所以将两块锌片分别插入两种不同浓度的ZnSO4溶液中不能组成原电池。()
正确答案:正确 -
第6题:
关于原电池的描述,下列说法不正确的是()。
- A、原电池是利用化学反应产生电流的装置
- B、原电池可以把化学能转变为电能
- C、原电池的负极发生氧化反应
- D、原电池的正极是流出电子的一极
正确答案:D -
第7题:
根据下列反应Fe+2HCl=FeCl2+H2组成原电池,正极反应式()负极反应式()。
正确答案:2H++2e=H2;Fe=Fe2++2e -
第8题:
现有酸性KMnO4和Pb(NO2)2溶液各一杯,选金属铂(Pt)棒插入KMnO4溶液中,金属铅(Pb)棒插入Pb(NO2)2溶液中,已知参与反应物质浓度均为1mol.L-1,φΘ(Pb2+/Pb)=-0.126V,φΘ(MnO4-/Mn2+)=+1.491V. (1)试判断该原电池反应自发进行的方向。 (2)完成并配平上述原电池反应方程式,以及两电极反应式。 (3)用电池符号表示该原电池,并计算其标准电动势和平衡常数。
正确答案: (1) 2MnO4-+5Pb+16H+=2Mn2++5Pb2++8H2O
(2) 负极:Pb=Pb2++2e 正极:MnO4-+8H++5e=Mn2++4H2O
(3)(-)Pb/Pb2+// MnO4-,Mn2+/Pt(+) K⊙=10273.1 -
第9题:
电位分析法中,分析钾离子活度(pK值),依据的是()
- A、原电池电动势与K+浓度成线形关系
- B、原电池电动势与K+活度成线形关系
- C、原电池电动势与K+浓度对数成线形关系
- D、原电池电动势与K+活度对数成线形关系
正确答案:C -
第10题:
下列说法正确的是()
- A、原电池的外电路上和电解液中流动的都是电子
- B、原电池的外电路上和电解液中流动的都是离子
- C、原电池的外电路上流动的是电子,电解液中流动的是离子
- D、原电池的外电路上流动的是离子,电解液中流动的是电子
正确答案:C -
第11题:
某些不属于氧化还原反应,也不经历氧化还原的过程也可以设计成原电池。()
正确答案:正确 -
第12题:
判断题腐蚀原电池实质上是一个断路的原电池。A对
B错
正确答案: 错解析: 暂无解析 -
第13题:
下列有关原电池的叙述中,正确的是( )。A: 原电池是将化学能转化为电能的装置
B: 用导线连接的两种不同金属同时插入液体中.能形成原电池
C: 在原电池中,电子流出的一极是负极,发生氧化反应
D: 原电池放电时,电解质溶液中的阳离子向正极移动答案:A,C,D解析:将两种活泼性不同的金属用导线连接后插入电解质溶液中,形成闭合回路,
这样才能形成原电池。B项说法错误。故本题答案选ACD。 -
第14题:
下列关于原电池的叙述中正确的是A.原电池能将化学能转变为电能 ? ? ? ?
B.原电池负极发生的是还原反应 ? ? ? ? ?
C.原电池在工作时,正极不断产生电子并经外电路流向负极 ? ? ?
D.原电池的电极只能由两种不同的金属构成答案:A解析:原电池负极发生氧化反应,正极发生还原反应;原电池中电子由负极流出经导线流向正极;原电池的电极中必须有一种是金属电极作负极,正极是金属或非金属、金属氧化物等均可。故选A。 -
第15题:
关于原电池下列表述不正确的是()
- A、由两种不同材料的电极组成
- B、碳电极不参与任何化学反应
- C、原电池在由化学能转换为电能时,负极被逐渐腐蚀而无法恢复
- D、原电池在由化学能转换为电能时,负极被逐渐腐蚀但能够恢复
正确答案:D -
第16题:
在Fe—Cu原电池中,其正极反应式及负极反应式正确的为()
- A、(+)Fe2++2e-=Fe;(-)Cu=Cu2++2e-
- B、(+)Fe=Fe2++2e-;(-)Cu2++2e-=Cu
- C、(+)Cu2++2e-=Cu;(-)Fe2++2e-=Fe
- D、(+)Cu2++2e-=Cu;(-)Fe=Fe2++2e-
正确答案:D -
第17题:
原电池是将()能转变为()能的装置。
正确答案:化学;电 -
第18题:
原电池两电极间的最大电位差叫做原电池的()。
正确答案:电动势 -
第19题:
将铜片插入盛有0.5mol/L的CuSO4溶液的烧杯中,银片插入盛有0.5mol/L的AgNO3,溶液的烧杯中,已知:φθ(Ag+/Ag)=0.7996V, φθ(Cu2+/Cu)=0.337V写出电极反应式和原电池的电池反应
正确答案:电极反应式: (-) Cu2++ 2e-←→ Cu (+) Ag++ e-←→ Ag
电池反应式: Cu+2Ag+←→ 2Ag+Cu2+ -
第20题:
用导线把原电池两极连接起来,将有电流产生.电子流动方向是由原电池的()流向()电流的方向是由原电池的()流向()。
正确答案:负;正极;正极;负极 -
第21题:
分别设计可测定下列数据的原电池:水的标准生成焓
正确答案:Pt︱H2(100KPa)︱KOH︱O2(100KPa)︱Pt -
第22题:
分别设计可测定下列数据的原电池:水的KW
正确答案:Pt︱H2(101.325KPa)︱KOH︱︱HCl︱︱H2(101.325KPa)︱Pt -
第23题:
分别设计可测定下列数据的原电池:0.1mol.kg-1HBr溶液的r-+
正确答案:Pt︱H2(100KPa)︱HBr(0.1mol.kg-1)︱AgBr(s)︱Ag -
第24题:
单选题电位分析法中,分析钾离子活度(pK值),依据的是()A原电池电动势与K+浓度成线形关系
B原电池电动势与K+活度成线形关系
C原电池电动势与K+浓度对数成线形关系
D原电池电动势与K+活度对数成线形关系
正确答案: B解析: 暂无解析
