将相同物质的量的HCl溶液和HAc溶液分别用同一NaOH溶液进行滴定时,滴定至溶液pH=7时,所消耗的NaOH体积,下列说法正确的是()A.不一样;NaOH溶液滴定HCl溶液至滴定化学计量点时,溶液pH=7;用相同量的NaOH溶液也可以滴定HAc溶液至化学计量点时溶液组成为NaAc, pH>7;#B.不一样;滴定HAc溶液至pH=7时,消耗的NaOH溶液比滴定HCl消耗的少;#C.一样;滴定至计量点时消耗的NaOH溶液相等;#D.不一样;滴定HAc溶液至pH=7时,消耗的NaOH溶液比滴定HCl消耗的多;
题目
将相同物质的量的HCl溶液和HAc溶液分别用同一NaOH溶液进行滴定时,滴定至溶液pH=7时,所消耗的NaOH体积,下列说法正确的是()
A.不一样;NaOH溶液滴定HCl溶液至滴定化学计量点时,溶液pH=7;用相同量的NaOH溶液也可以滴定HAc溶液至化学计量点时溶液组成为NaAc, pH>7;#B.不一样;滴定HAc溶液至pH=7时,消耗的NaOH溶液比滴定HCl消耗的少;#C.一样;滴定至计量点时消耗的NaOH溶液相等;#D.不一样;滴定HAc溶液至pH=7时,消耗的NaOH溶液比滴定HCl消耗的多;相似考题
更多“将相同物质的量的HCl溶液和HAc溶液分别用同一NaOH溶液进行滴定时,滴定至溶液pH=7时,所消耗的NaOH体积,下列说法正确的是()”相关问题
-
第1题:
为使HAc溶液的电离度和溶液的pH都增加,往HAc溶液中加的物质应是下列中哪一种?A. NaAc 晶体
B. NaOH 晶体
C. HCl(g)
D. NaCl 晶体答案:B解析:提示:在HAc溶液中存在: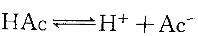 。为使电离度增加,必须使平衡向右移动;为使pH值增加,必须使H+离子浓度下降。
。为使电离度增加,必须使平衡向右移动;为使pH值增加,必须使H+离子浓度下降。 -
第2题:
将pH=2.00的HCl溶液与pH=13.00的NaOH溶液等体积混合后,溶液的pH值是( )。A.7.00
B.12.65
C.3.00
D.11.00答案:B解析:
-
第3题:
NaOH因保存不当吸收了CO2,若以此NaOH溶液滴定HAc至计量点,则HAc的分析结果将()。
正确答案:偏高 -
第4题:
用0.1mol·L-1NaOH溶液分别与HCl和HAc溶液各20ml反应时,均消耗掉20ml的NaOH,这表示()。
- A、HCl和HAc溶液中,H+浓度相等
- B、HCl和HAc溶液的物质的量浓度相等
- C、HCl和HAc溶液的pH相等
- D、HCl和HAc的质量浓度相等
正确答案:B -
第5题:
体积相同、pH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时两者消耗NaOH的物质的量()。
- A、相同
- B、HCl多
- C、CH3COOH多
- D、无法比较
正确答案:C -
第6题:
浓度为0.1000mol/L的NaOH溶液滴定相同浓度的HAc溶液,理论终点时溶液显()。
正确答案:碱性 -
第7题:
中和等体积pH相同的HCl和HAc溶液,所需的NaOH的量相同。
正确答案:错误 -
第8题:
下列说法不正确的*是()
- A、用NaOH中和pH相同,体积相等的HAc和HCl溶液,所需NaOH的量相等.
- B、用HCl溶液中和pH相同,体积相等的Ba(OH)2和 NaOH溶液,所需HCl的量相等.
- C、用NaOH中和物质的量浓度相同,体积相等的HAc和 HCl溶液,所需NaOH的量相等.
- D、用HCl中和物质的量浓度和体积相同的KOH和NH3水溶液所需HCl的量相等
正确答案:A -
第9题:
为使HAc溶液的电离度和溶液的pH都增加,往HAc溶液中加的物质应是下列中哪一种?()
- A、NaAc晶体
- B、NaOH晶体
- C、HCl(g)
- D、NaCl晶体
正确答案:B -
第10题:
用同一NaOH溶液分别滴定体积相等的H2SO4和HAc溶液,消耗的体积相等,说明H2SO4和HAc两溶液中的()
- A、氢离子浓度相等
- B、H2SO4和HAc的浓度相等
- C、H2SO4的浓度为HAc浓度的1/2
- D、两个滴定的pH突跃范围相同
正确答案:C -
第11题:
在相同体积相同浓度的HAc(aq)和HCl(aq)中,所含的氢离子浓度();若用相同浓度的NaOH溶液去完全中和这两种溶液时,所消耗的NaOH溶液的体积(),恰好中和时两溶液的pH值()。
正确答案:不相等;相等;不同 -
第12题:
单选题体积相同、pH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时两者消耗NaOH的物质的量()。A相同
BHCl多
CCH3COOH多
D无法比较
正确答案: A解析: 暂无解析 -
第13题:
将pH=2.00 的HCl 溶液与pH=13.00 的NaoH 溶液等体积混合后,溶液的pH 值是:
(A)7.00 (B)12.65
(C)3.00 (D)11.00答案:B解析: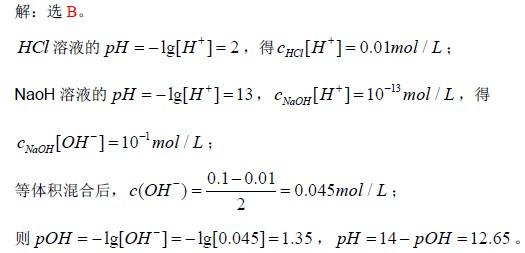
-
第14题:
用同一NaOH溶液,分别与相同体积的盐酸、醋酸溶液反应,完全反应后消耗了相同量的NaOH溶液.由此说明该盐酸和醋酸溶液的关系是( )A.H+浓度相同
B.物质的量浓度相同
C.溶质的质量分数相同
D.pH相同答案:B解析:【解题指要】 (1)首先应明确盐酸、醋酸溶液分别与NaOH溶液反应,消耗NaOH溶液的量与盐酸、醋酸溶液中所含溶质的量成正比. 从反应方程式中可知它们的质量比和物质的量之比.
由此可知,若消耗NaOH溶液的量相等,则盐酸、醋酸溶液中所含溶质的物质的量一定相等,但质量一定不等,即n(HCl)=n(CH3COOH),m(HCl)≠m(CH3COOH).
质的量浓度相等.故B选项正确.
因不知溶液的总质量,所以溶质的质量分数一般不同,即C选项错误.
(2)其次,应知道盐酸是强酸,醋酸是弱酸,它们的电离程度不同.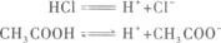
当HCl、CH3COOH的物质的量相同时,溶液中H+的物质的量一定不同,即H+的物质的量浓度一定不同.所以A选项错误.
(3)根据pH=-lg c(H+)可知,H+浓度不同,溶液的pH也一定不同,即溶液的酸性强弱不同.所以D选项也错误. -
第15题:
将pH=2的HCl溶液和pH=13的NaOH溶液等体积混合后,溶液的pH值为()。
- A、7.00
- B、12.50
- C、3.00
- D、11.00
正确答案:B -
第16题:
有下列溶液: ①0.01mol·L-1HAc溶液; ②0.01mol·L-1HAc与等体积等浓度的NaOH溶液混合; ③0.01mol·L-1HAc与等体积等浓度的HCl溶液混合; ④0.01mol·L-1HAc与等体积等浓度的NaAc溶液混合。 其pH值排列顺序正确的是()。
- A、①>②>③>④
- B、①>③>②>④
- C、④>③>②>①
- D、②>④>①>③
正确答案:D -
第17题:
用C(NaOH) = 0.1000mol/L的NaOH溶液20.00ml滴定相同体积、相同浓度的HCl溶液,当滴加的NaOH溶液为19. 98ml时,体系的pH = 3.30。
正确答案:错误 -
第18题:
强碱滴定弱酸NaOH-HAc和强碱滴定强酸NaOH-HCl的滴定曲线的区别有()。
- A、NaOH-HAc滴定曲线起点的pS值NaOH-HCl滴定曲线起点的pH值高
- B、NaOH-HAc滴定开始后pH值升高较快
- C、NaOH-HAc滴定体系在临近化学计量时溶液的pH值在碱性范围内
- D、当接近化学计量点时,NaOH-HAc滴定曲线的斜率迅速降低
正确答案:A,B,C -
第19题:
今有下列几种酸碱滴定: (A)0.1molL-1NaOH溶液滴定等浓度的HCl溶液 (B)0.1molL-1NaOH溶液滴定等浓度的HAc溶液 (C)0.1molL-1NaOH溶液滴定等浓度的HCOOH溶液 (D)1.0molL-1NaOH溶液滴定等浓度的HCl溶液 则四种滴定突跃范围由大到小的顺序是()。
正确答案:D-A-C-B -
第20题:
分别中和同体积的pH相同的NaOH和NH3水溶液,所需HCl溶液的量为();中和等体积等浓度的HCl和HAc溶液,所需的NaOH的量为()。(填相等或不相等)
正确答案:不相等;相等 -
第21题:
计算题:称取一不纯的Na2CO3样品1.0538g,用除盐水稀释至100ml,准确吸取25ml,以甲基橙为指示剂,用c(HCL)=0.19mol/L的HCL溶液滴定,消耗HCL溶液30ml,又以c(NaOH)=0.1mol/L的NaOH溶液回滴至终点,消耗NaOH溶液10.38ml,求该样品的纯度。
正确答案: NaOH+HCL=NaCL+H2.O
0.1×10.38/0.19=5.46(ml)用C(HCL)=0.19mol/L的HCL溶液滴定Na2CO3消耗的毫升数
Na2CO3+2HCL=2NaCL+H2SO3
30-5.46=24.34(ml)NaCO3的实际重量为
24.6×0.19/25×53×100/1000=0.99
Na2CO3的纯度为0.99/1.0538×100%=93.9%
Na2CO3的纯度为93.9%。 -
第22题:
相同体积相同浓度的HAc和HCl溶液中,所含的[H+]();若用相同浓度的溶液分别完全中和这两种酸溶液时,所消耗的NaOH溶液的体积(),恰好中和时两溶液的pH(),前者的pH比后者的pH()。
正确答案:不相等;相同;不同;大 -
第23题:
填空题现有pH相同的盐酸和醋酸溶液,它们的物质的量浓度为c(HCl)____c(CH3COOH)(选填大于、小于或等于).若取相同体积的此盐酸和醋酸溶液,用同NaOH溶液去中和它们,完全反应所需NaOH溶液的体积____(选填相同或不同).正确答案: 小于,不同解析:
HCl为强酸,CH3COOH为弱酸,pH相同就是c(H+)相同,盐酸中c(H+)=c(HCI),醋酸中c(H+)<c(CH3COOH);因c(HCl)与c(CH3COOH)不同,所以与NaOH溶液完全反应,消耗的NaOH也不相同. -
第24题:
单选题用同一NaOH溶液分别滴定体积相等的H2SO4和HAc溶液,消耗的体积相等,说明H2SO4和HAc两溶液中的()A氢离子浓度相等
BH2SO4和HAc的浓度相等
CH2SO4的浓度为HAc浓度的1/2
D两个滴定的pH突跃范围相同
正确答案: A解析: 暂无解析
