申报新药时必须报送的药理、毒理研究资料有:①主要药效学试验资料;②一般药理试验资料;③急性毒性,长期毒性试验资料;④致突变,致癌试验资料等。A.①+②+③+④B.①+②+③C.①+③D.③+④E.以上均不正确申报Ⅱ类新药须报送的资料有
题目
B.①+②+③
C.①+③
D.③+④
E.以上均不正确
相似考题
参考答案和解析
更多“申报新药时必须报送的药理、毒理研究资料有:①主要药效学试验资料;②一般药理试验资料;③急性毒性,长期毒性试验资料;④致突变,致癌试验资料等。A.①+②+③+④B.①+②+③C.①+③D.③+④E.以上均不正确”相关问题
-
第1题:
申报五类中药新药制剂,不需报送的资料是
A.主要药效学试验
B.一般药理试验
C.急性毒性试验
D.长期毒性试验
E.致突变试验
正确答案:E
-
第2题:
属于化学药品注册申报资料中“综述资料”的是( )。
A.立题目的与依据
B.对主要研究结果的总结及评价
C.药学研究资料综述
D.药理毒理研究资料综述
E.证明性文件
正确答案:ABE
-
第3题:
新药进行临床试验必须提供()
A.系统药理研究数据
B.新药作用谱
C.临床前研究资料
D.LD50
E.急慢性毒理研究数据
正确答案:C
-
第4题:
动物毒性试验包括
A.急性毒性试验
B.亚急性毒性试验
C.慢性毒性试验
D.一般药效学试验
E.特殊毒性试验
正确答案:ABCE
-
第5题:
化学药品注册分类I至V类新药审批的一般程序是
A.提供符合规定的综述资料、药学研究资料、药理毒理研究资料、临床研究资料,向SFDA申请临床试验批文
B.申办者选择或由SFDA指定具有资质的国家药品研究基地为临床研究单位
C.取得SFDA批文后进行临床研究(Ⅰ、Ⅱ、Ⅲ期)
D.提供临床研究资料及临床前研究资料,经审评合格取得试生产批文试生产期间进行药品生产质量观察及Ⅳ期临床试验,并在试生产满前3个月,提供有关资料申请转正
E.审批合格后转为正式生产
正确答案:ABCDE
-
第6题:
申报新药时必须报送的药理、毒理研究资料有:①主要药效学试验资料;②一般药理试验资料;③急性毒性,长期毒性试验资料;④致突变,致癌试验资料等。A.①+②+③+④
B.①+②+③
C.①+③
D.③+④
E.以上均不正确申报Ⅰ类新药须报送的资料有答案:A解析: -
第7题:
致畸、致癌、致突变试验属于A.急性毒性试验
B.长期毒性试验
C.特殊毒性试验
D.Ⅰ期临床试验
E.Ⅳ期临床试验答案:C解析:特殊毒性试验包括对视觉、听力的影响,对肝、肾等重要脏器的影响,局部刺激性,过敏反应,热原试验及致癌、致畸、致突变试验。 -
第8题:
报送新药时不需要提供的资料是A.研制依据B.检验数据C.药理试验结果D.开发单位财务年报E.质量标准答案:D解析:按照新药报送时需要提供资料的要求,即可选出答案。 -
第9题:
新药进行临床试验必须提供?()
- A、系统药理研究数据
- B、慢性毒性实验结果
- C、LD50
- D、临床前研究资料
- E、核算药物成本
正确答案:A,B,C,D -
第10题:
新药进行临床试验必须提供:
- A、急性毒性观察结果
- B、药物的成本
- C、慢性毒性观察结果
- D、系统药理研究数据
- E、临床前研究资料
正确答案:A,C,D,E -
第11题:
单选题新药进行临床试验必须提供()A系统药理研究数据
B急、慢性毒性观察结果
C新药作用谱
DLD50
E临床前研究资料
正确答案: A解析: 暂无解析 -
第12题:
多选题新药进行临床试验必须提供?()A系统药理研究数据
B慢性毒性实验结果
CLD50
D临床前研究资料
E核算药物成本
正确答案: C,E解析: 暂无解析 -
第13题:
化学药品注册分类I类至V类新药审批的一般程序是( )。
A.提供符合规定的综述资料、药学研究资料药理毒理研究资料、临床研究资料,向SFDA申请临床试验批文
B.申办者选择或由SFDA指定具有资质的国家药品研究基地为临床研究单位
C.取得SFDA批文后进行临床研究(I、Ⅱ、Ⅲ期)
D.提供临床研究资料及临床前研究资料,经审评合格取得试生产批文,试生产期间进行药品生产质量观察及Ⅳ期临床试验,并在试生产满前3个月,提供有关资料申请转正
E.审批合格后转为正式生产
正确答案:ABCDE
-
第14题:
新药在开始Ⅰ期临床试验前,必须完成的实验有( )。
A.慢性毒性实验
B.系统药理实验
C.一般药理实验
D.特殊毒性实验
E.药效学实验
正确答案:ABCDE
-
第15题:
申报二类中药新药制剂,不需报送的资料是
A.主要药效学试验
B.一般药理试验
C.急性毒性试验
D.长期毒性试验
E.致突变试验
正确答案:E
E。申报二类中药新药制剂,不需要报送致突变试验资料、致癌试验资料及生殖毒性试验资料。故本题最佳答案为E。
-
第16题:
报送新药时不需要提供的资料是
A.研制依据及制造方法
B.检验数据
C.药理及毒理试验结果
D.开发单位财务年报
E.质量标准及起草说明
正确答案:D
-
第17题:
新药进行临床试验必须提供A.系统药理研究数据
B.急慢性毒性观察结果
C.新药作用谱
D.LD.50
E.临床前研究资料答案:E解析:新药进行临床试验必须提供临床前研究资料。 -
第18题:
在我国现行的毒理学安全性评价程序中,列入第三阶段的毒理学试验通常包括A.蓄积试验、致突变试验
B.亚慢性毒性试验、致畸试验
C.慢性毒性试验、致癌试验
D.急性毒性试验、皮肤粘膜试验
E.短期喂养试验、代谢试验答案:B解析:本题考查毒理学安全性评价程序的不同阶段的试验项目,第一阶段包括急性毒性试验和局部毒性试验;第二阶段一般包括蓄积试验和致突变试验;第三阶段一般包括亚慢性毒性试验、生殖与发育毒性试验和代谢试验;第四阶段为慢性毒性试验和致癌试验。 -
第19题:
致突变试验属于A.急性毒性试验
B.长期毒性试验
C.特殊毒性试验
D.Ⅰ期临床试验
E.Ⅳ期临床试验答案:C解析:特殊毒性试验包括对视觉、听力的影响,对肝、肾等重要脏器的影响,局部刺激性,过敏反应,热原试验及致癌、致畸、致突变试验。 -
第20题:
新药进行临床试验必须提供A.系统药理研究数据
B.急慢性毒性观察结果
C.新药作用谱
D.LD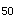
E.临床前研究资料答案:E解析: -
第21题:
新药进行临床试验必须提供()
- A、系统药理研究数据
- B、急、慢性毒性观察结果
- C、新药作用谱
- D、LD50
- E、临床前研究资料
正确答案:E -
第22题:
单选题申报二类中药新药制剂,不需报送的资料是( )。A主要药效学试验
B一般药理试验
C急性毒性试验
D长期毒性试验
E致突变试验
正确答案: E解析:
申报二类中药新药制剂,不需要报送致突变试验资料、致癌试验资料及生殖毒性试验资料。故本题最佳答案为E。 -
第23题:
多选题新药进行临床试验必须提供:A急性毒性观察结果
B药物的成本
C慢性毒性观察结果
D系统药理研究数据
E临床前研究资料
正确答案: C,B解析: 暂无解析 -
第24题:
单选题申报五类中药新药制剂,不需报送的资料是( )。A主要药效学试验
B一般药理试验
C急性毒性试验
D长期毒性试验
E致突变试验
正确答案: A解析:
申报五类中药新药制剂,不需报送致突变试验的资料。
